2023年3月8日,藥監(jiān)總局發(fā)布《2022年度醫(yī)療器械注冊工作報告》���,一起來看2022年這個特別的年度��,我國醫(yī)療器械注冊工作情況�,一起來看看藥監(jiān)總局及地方藥監(jiān)��、醫(yī)療器械行業(yè)從業(yè)者們做了哪些事���,取得了哪些成果����。
2023年3月8日��,藥監(jiān)總局發(fā)布《2022年度醫(yī)療器械注冊工作報告》�����,一起來看2022年這個特別的年度���,我國醫(yī)療器械注冊工作情況,一起來看看藥監(jiān)總局及地方藥監(jiān)����、醫(yī)療器械行業(yè)從業(yè)者們做了哪些事���,取得了哪些成果。
2022年度醫(yī)療器械注冊工作報告(上半部分)
2022年��,國家藥監(jiān)局以習(xí)近平新時代中國特色社會主義思想為指導(dǎo)���,深入學(xué)習(xí)貫徹黨的二十大精神��,全面落實黨中央國務(wù)院重大決策部署����,按照習(xí)近平總書記“四個最嚴(yán)”要求�,堅持以人民健康為中心,堅持保安全守底線���,促發(fā)展追高線����,認真執(zhí)行《醫(yī)療器械監(jiān)督管理條例》����,繼續(xù)做好疫情防控產(chǎn)品審評審批工作�����,全面深化醫(yī)療器械審評審批制度改革�,強化醫(yī)療器械注冊管理���,助推產(chǎn)業(yè)創(chuàng)新高質(zhì)量發(fā)展���,醫(yī)療器械注冊管理各項工作有力向前推進。
一�����、醫(yī)療器械注冊工作情況
?��。ㄒ唬┮咔榉揽胤?wù)保障全力以赴
2022年��,國家藥監(jiān)局堅決貫徹落實黨中央國務(wù)院重大決策部署����,將疫情防控產(chǎn)品應(yīng)急審批作為重大政治任務(wù)�����。共批準(zhǔn)68個新冠病毒檢測試劑�����,截至2022年年底��,共批準(zhǔn)新冠病毒檢測試劑136個(包括45個核酸檢測試劑����、41個抗體檢測試劑、50個抗原檢測試劑)����,為疫情防控工作提供了有力保障。持續(xù)做好新冠病毒突變株監(jiān)測和核酸�、抗原檢測試劑檢出能力評估,確保已批準(zhǔn)試劑對新冠病毒突變株的檢測質(zhì)量�。2022年4月,由我國組織制定的國際標(biāo)準(zhǔn)《體外診斷檢測系統(tǒng)-核酸擴增法檢測新型冠狀病毒(SARS-CoV-2)的要求及建議》獲得ISO批準(zhǔn)發(fā)布���。
2022年����,國家藥監(jiān)局根據(jù)疫情防控形勢和要求的變化�����,全力做好新冠病毒抗原檢測試劑優(yōu)先審評審批工作,新批準(zhǔn)47個新冠病毒抗原檢測試劑��,延長已獲批新冠抗原檢測試劑注冊證有效期���,充分滿足疫情防控需要���。
2022年,國家藥監(jiān)局還啟動了新冠病毒核酸采樣設(shè)備應(yīng)急審批���。組織修訂《醫(yī)用外科口罩》《一次性使用醫(yī)用口罩》行業(yè)標(biāo)準(zhǔn)�����。全程指導(dǎo)注冊申請人做好體外膜肺氧合(ECMO)產(chǎn)品注冊研發(fā)����,推動產(chǎn)品盡快上市���。
?���。ǘ?促進產(chǎn)業(yè)創(chuàng)新高質(zhì)量發(fā)展成果豐碩
2022年�,國家藥監(jiān)局按程序做好創(chuàng)新醫(yī)療器械、臨床急需醫(yī)療器械審評審批��,高端醫(yī)療裝備國產(chǎn)化有新突破�����,批準(zhǔn)首個國產(chǎn)質(zhì)子治療系統(tǒng)等創(chuàng)新醫(yī)療器械55個(總數(shù)為189個)����,優(yōu)先審批醫(yī)療器械77個(總數(shù)為126個),創(chuàng)新醫(yī)療器械獲批數(shù)量與2021年相比增加57.1%���,更好地滿足人民群眾使用高水平醫(yī)療器械需要���。
2022年,工業(yè)和信息化部�����、國家藥監(jiān)局聯(lián)合印發(fā)人工智能醫(yī)療器械創(chuàng)新任務(wù)揭榜入圍單位名單�,啟動生物醫(yī)用材料創(chuàng)新任務(wù)揭榜掛帥工作,進一步激發(fā)產(chǎn)業(yè)發(fā)展活力�。
2022年��,國家藥監(jiān)局落實國家重大區(qū)域發(fā)展戰(zhàn)略要求���,印發(fā)港澳醫(yī)療器械注冊人在粵港澳大灣區(qū)內(nèi)地9市生產(chǎn)醫(yī)療器械實施方案,進一步推動區(qū)域產(chǎn)業(yè)發(fā)展����。牽頭組織推進海南博鰲樂城國際醫(yī)療旅游先行區(qū)臨床真實世界數(shù)據(jù)應(yīng)用試點工作,批準(zhǔn)熱蒸汽治療設(shè)備及一次性使用前列腺熱蒸汽治療器械4個試點品種上市�,指導(dǎo)召開了首屆博鰲藥械真實世界研究大會,真實世界數(shù)據(jù)應(yīng)用和研究取得新突破�����。
?。ㄈ┽t(yī)療器械注冊審評審批工作持續(xù)規(guī)范
2022年,國家藥監(jiān)局修訂發(fā)布《關(guān)于第一類醫(yī)療器械備案有關(guān)事項的公告》��,加強備案工作培訓(xùn)指導(dǎo)��,完成全部“冷敷貼”“冷敷凝膠”產(chǎn)品備案清理����,及時糾正顯微針、口鼻氣霧給藥器等備案不規(guī)范行為。開展境內(nèi)第二類醫(yī)療器械注冊清理規(guī)范��,梳理第二類醫(yī)療器械近80000件�����,組織抽查31個省168個案卷�,有效規(guī)范第二類醫(yī)療器械注冊工作秩序�����。
2022年��,國家藥監(jiān)局會同國家衛(wèi)生健康委修訂發(fā)布《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》(GCP)�,進一步規(guī)范臨床試驗過程,確保臨床試驗結(jié)果真實�、準(zhǔn)確、完整和可追溯�。開展2022年度醫(yī)療器械臨床試驗監(jiān)督檢查(包括臨床試驗產(chǎn)品的真實性核查)。發(fā)布《醫(yī)療器械注冊質(zhì)量管理體系核查指南》����,提高醫(yī)療器械注冊人制度下醫(yī)療器械注冊質(zhì)量管理體系核查工作質(zhì)量。
?���。ㄋ模┽t(yī)療器械注冊管理技術(shù)支撐體系不斷完善
2022年�,國家藥監(jiān)局持續(xù)完善醫(yī)療器械標(biāo)準(zhǔn)體系�����,批準(zhǔn)醫(yī)療器械行業(yè)標(biāo)準(zhǔn)制修訂計劃項目116項��,審核發(fā)布行業(yè)標(biāo)準(zhǔn)114項�����,將92項強制性行業(yè)標(biāo)準(zhǔn)和在研項目轉(zhuǎn)化為推薦性�,廢止20項強制性行業(yè)標(biāo)準(zhǔn),標(biāo)準(zhǔn)體系覆蓋性�、系統(tǒng)性不斷提升。會同工業(yè)和信息化部��,組建醫(yī)療裝備產(chǎn)業(yè)與應(yīng)用標(biāo)準(zhǔn)化工作組����。成立中醫(yī)器械標(biāo)準(zhǔn)化技術(shù)歸口單位,籌建口腔數(shù)字化醫(yī)療器械標(biāo)準(zhǔn)化技術(shù)歸口單位�����、醫(yī)療器械可靠性與維修性標(biāo)準(zhǔn)化技術(shù)歸口單位。部署對標(biāo)委會開展首次全覆蓋式考核評估�����。統(tǒng)籌推進新版GB 9706系列標(biāo)準(zhǔn)實施��,強化省級藥品監(jiān)管部門����、注冊人責(zé)任����,印發(fā)《GB 9706.1-2020及配套并列標(biāo)準(zhǔn)、專用標(biāo)準(zhǔn)實施工作方案》���,全覆蓋開展宣貫培訓(xùn)�����,研究制定新版GB 9706標(biāo)準(zhǔn)檢測設(shè)備清單���、檢驗操作規(guī)程和檢驗報告編制規(guī)范等。
2022年�����,國家藥監(jiān)局加強完善醫(yī)療器械分類管理工作,完成分類技術(shù)委員會換屆���。及時研究明確熱瑪吉����、水光針產(chǎn)品管理屬性和類別��,修訂發(fā)布《關(guān)于醫(yī)用透明質(zhì)酸鈉產(chǎn)品管理類別的公告》����,發(fā)布《關(guān)于調(diào)整<醫(yī)療器械分類目錄>部分內(nèi)容的公告》,根據(jù)醫(yī)療器械風(fēng)險程度��,科學(xué)合理地調(diào)整有關(guān)產(chǎn)品描述�、預(yù)期用途、管理類別等�。
2022年,國家藥監(jiān)局持續(xù)推進唯一標(biāo)識工作����,督導(dǎo)各省指導(dǎo)企業(yè)開展第二批唯一標(biāo)識實施工作,起草形成《關(guān)于做好第三批實施醫(yī)療器械唯一標(biāo)識工作的公告(征求意見稿)》�����,公開征求意見。
2022年�����,國家藥監(jiān)局醫(yī)療器械技術(shù)審評中心發(fā)布技術(shù)審查指導(dǎo)原則95項��,目前我國醫(yī)療器械技術(shù)審查指導(dǎo)原則已達529項��,對醫(yī)療器械分類目錄覆蓋率達86.9%���,醫(yī)療器械產(chǎn)品安全有效評價工具日趨成熟���。
?��。ㄎ澹┽t(yī)療器械注冊管理能力全面提升
2022年���,國家藥監(jiān)局不斷提升醫(yī)療器械注冊管理能力。繼續(xù)做好政府購買服務(wù)項目���,加強動態(tài)監(jiān)測和工作績效季度管理��,并開展季度評估��,購買服務(wù)工作進一步規(guī)范�,技術(shù)審評效能進一步提升。加大全國醫(yī)療器械技術(shù)審評人員培訓(xùn)力度���,舉辦兩期醫(yī)療器械注冊法規(guī)和注冊管理實務(wù)培訓(xùn)班����,制定實訓(xùn)基地建設(shè)工作方案����,統(tǒng)籌北京、上海�����、江蘇����、浙江、山東�、廣東等6個實訓(xùn)基地工作,線上開展專業(yè)培訓(xùn)12次���,培訓(xùn)8000多人次���。
2022年���,國家藥監(jiān)局全面提升醫(yī)療器械注冊信息化水平,2022年10月起����,醫(yī)療器械注冊主要辦理事項全面實施電子化審評審批,印發(fā)《國家藥監(jiān)局關(guān)于全面實施醫(yī)療器械電子注冊證的公告》(2022年第91號)�����,2022年11月1日起全面發(fā)放醫(yī)療器械電子注冊證����,國家藥監(jiān)局全業(yè)務(wù)流程電子化基本完成���。
2022年�,國家藥監(jiān)局持續(xù)推進醫(yī)療器械監(jiān)管科學(xué)研究工作��,組織推進第二批監(jiān)管科學(xué)研究6個重點項目��,推動13個醫(yī)療器械子項目加快研究進度、加速成果轉(zhuǎn)化�。積極參與國際組織工作,參加IMDRF管理委員會電話會��,組織制定2022年GHWP年會及換屆相關(guān)工作方案�,配合做好換屆籌備和競選相關(guān)工作。
二�����、醫(yī)療器械注冊申請受理情況
2022年���,國家藥監(jiān)局依職責(zé)共受理醫(yī)療器械首次注冊���、延續(xù)注冊和變更注冊申請共計10571項,與2021年相比減少13.7%�����。
?。ㄒ唬┱w情況
受理境內(nèi)第三類醫(yī)療器械注冊申請5425項,受理進口醫(yī)療器械注冊申請5146項�。
按注冊品種區(qū)分,醫(yī)療器械注冊申請8105項,體外診斷試劑注冊申請2466項��。
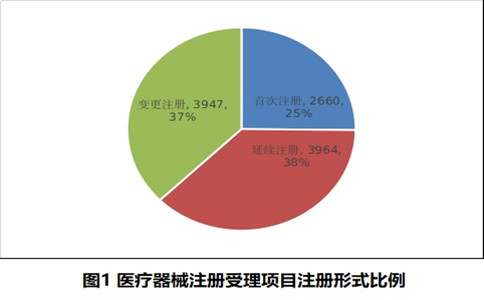
按注冊形式區(qū)分�����,首次注冊申請2660項���,占全部醫(yī)療器械注冊申請的25.2%����;延續(xù)注冊申請3964項��,占全部醫(yī)療器械注冊申請的37.5%��;變更注冊申請3947項�����,占全部醫(yī)療器械注冊申請的37.3%�����。注冊形式比例情況見圖1�。
(二)分項情況
1.境內(nèi)第三類醫(yī)療器械注冊受理情況
境內(nèi)第三類醫(yī)療器械注冊受理共5425項���,與2021年相比增加1.6%����。其中,醫(yī)療器械注冊申請4138項�,體外診斷試劑注冊申請1287項。
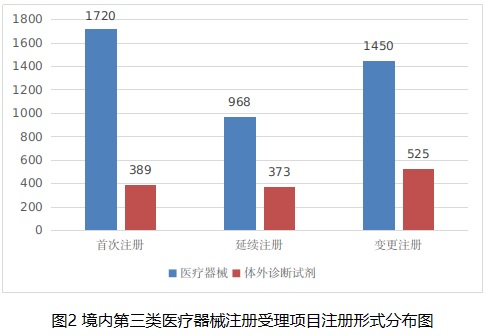
從注冊形式看����,首次注冊2109項,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的38.9%���;延續(xù)注冊1341項��,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的24.7%�;變更注冊1975項���,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的36.4%��。注冊形式分布情況見圖2����。
2.進口第二類醫(yī)療器械注冊受理情況
進口第二類醫(yī)療器械注冊受理共2467項,與2021年相比減少33.1%��。其中醫(yī)療器械注冊申請1590項����,體外診斷試劑注冊申請877項。
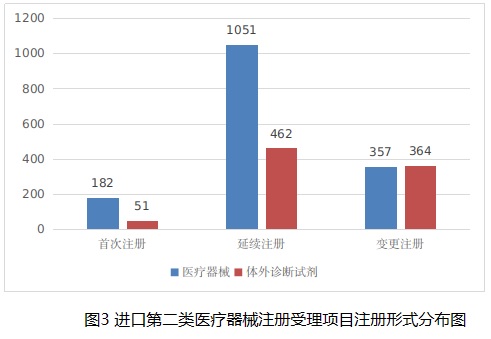
從注冊形式看��,首次注冊233項����,占全部進口第二類醫(yī)療器械注冊申請數(shù)量的9.4%;延續(xù)注冊1513項���,占全部進口第二類醫(yī)療器械注冊申請數(shù)量的61.3%����;變更注冊721項��,占全部進口第二類醫(yī)療器械注冊申請數(shù)量的29.2%����。注冊形式分布情況見圖3。
3.進口第三類醫(yī)療器械注冊受理情況
進口第三類醫(yī)療器械注冊受理共2679項���,與2021年相比減少17%�。其中醫(yī)療器械注冊申請2377項�,體外診斷試劑注冊申請302項。
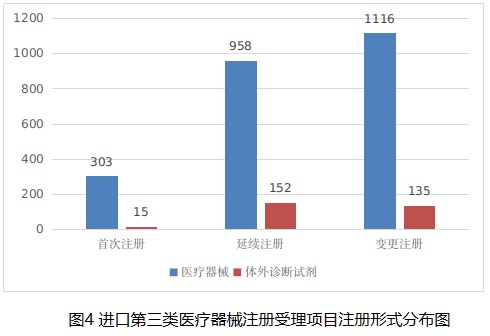
從注冊形式看�����,首次注冊318項�����,占全部進口第三類醫(yī)療器械注冊申請數(shù)量的11.9%�����;延續(xù)注冊1110項���,占全部進口第三類醫(yī)療器械注冊申請數(shù)量的41.4%����;變更注冊1251項�����,占全部進口第三類醫(yī)療器械注冊申請數(shù)量的46.7%。注冊形式分布情況見圖4���。
三��、醫(yī)療器械注冊審批情況
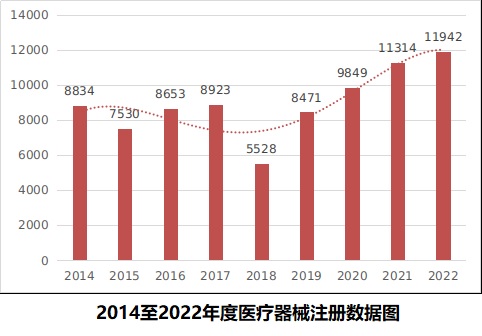
2022年�����,國家藥監(jiān)局共批準(zhǔn)醫(yī)療器械首次注冊�����、延續(xù)注冊和變更注冊11942項�����,與2021年相比注冊批準(zhǔn)總數(shù)量增長5.5%�����。
其中���,首次注冊2500項,與2021年相比增加46.2%����。延續(xù)注冊5218項�,與2021年相比減少24.8%��。變更注冊4224項��,與2021年相比增加58.5%���。
2022年,企業(yè)自行撤回首次注冊申請�����、自行注銷注冊證書214項���。
近9年國家藥監(jiān)局批準(zhǔn)醫(yī)療器械注冊情況見圖5��。
(一)整體情況
2022年����,國家藥監(jiān)局批準(zhǔn)境內(nèi)第三類醫(yī)療器械注冊5692項��,與2021年相比增加23.8%���,進口醫(yī)療器械6250項����,與2021年相比減少7%。
按照注冊品種區(qū)分����,醫(yī)療器械8942項,占全部醫(yī)療器械注冊數(shù)量的74.9%�����;體外診斷試劑3000項����,占全部醫(yī)療器械注冊數(shù)量的25.1%。
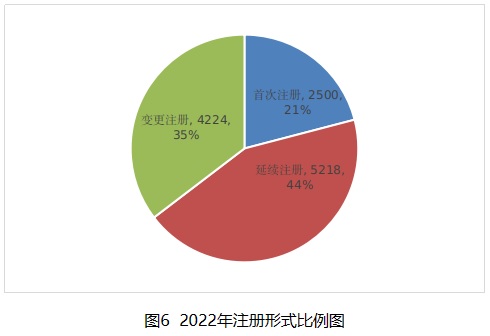
按照注冊形式區(qū)分���,首次注冊2500項����,占全部醫(yī)療器械注冊數(shù)量的20.9%��;延續(xù)注冊5218項���,占全部醫(yī)療器械注冊數(shù)量的43.7%��;變更注冊4224項�����,占全部醫(yī)療器械注冊數(shù)量的35.4%�����。注冊形式比例情況見圖6�。
?�。ǘ┓猪椙闆r
1.境內(nèi)第三類醫(yī)療器械注冊審批情況
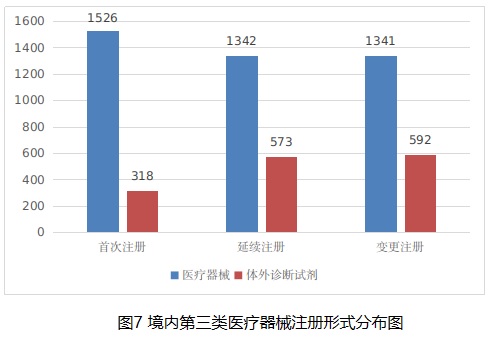
境內(nèi)第三類醫(yī)療器械注冊5692項�。其中,醫(yī)療器械4209項��,體外診斷試劑1483項��。
從注冊形式看����,首次注冊1844項,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的32.4%�����,延續(xù)注冊1915項,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的33.6%�;許可事項變更注冊1933項,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的34%�����。注冊形式分布情況見圖7���。
2.進口第二類醫(yī)療器械注冊審批情況
進口第二類醫(yī)療器械注2985項����。其中�����,醫(yī)療器械注冊1908項��,體外診斷試劑注冊1077項����。
從注冊形式看,首次注冊309項,占全部進口第二類醫(yī)療器械注冊數(shù)量的10.4%����;延續(xù)注冊1761項,占全部進口第二類醫(yī)療器械注冊數(shù)量的56.9%���;許可事項變更注冊1003項�����,占全部進口第二類醫(yī)療器械注冊數(shù)量的32.8%�。注冊形式分布情況見圖8�����。
3.進口第三類醫(yī)療器械注冊審批情況
進口第三類醫(yī)療器械注冊3265項�。其中���,醫(yī)療器械注冊2825項�����,體外診斷試劑注冊440項�。
從注冊形式看,首次注冊347項�,占全部進口第三類醫(yī)療器械注冊數(shù)量的10.6%;延續(xù)注冊1606項��,占全部進口第三類醫(yī)療器械注冊數(shù)量的49.2%����;許變更注冊1312項,占全部進口第三類醫(yī)療器械注冊數(shù)量的40.2%�����。
(三)首次注冊項目月度審批情況
2022年�,國家藥監(jiān)局共批準(zhǔn)醫(yī)療器械首次注冊2500項,月度審批情況見圖10����。
(四)具體批準(zhǔn)品種種類分析
注冊的境內(nèi)第三類醫(yī)療器械,除體外診斷試劑外�����,共涉及《醫(yī)療器械分類目錄》中18個子目錄的產(chǎn)品����。
注冊數(shù)量前五位的境內(nèi)第三類醫(yī)療器械是:無源植入器械,神經(jīng)和心血管手術(shù)器械,注輸�、護理和防護器械,醫(yī)用成像器械��,有源手術(shù)器械����。與2021年相比,神經(jīng)和心血管手術(shù)器械注冊產(chǎn)品數(shù)量超過注輸�����、護理和防護器械���,且相同類別注冊數(shù)量均有大幅增加��,其中有源手術(shù)器械增加76.6%��,醫(yī)用成像器械增加78%����,神經(jīng)和心血管手術(shù)器械增加92.2%��,無源植入器械增加68.4%�����。
注冊的進口醫(yī)療器械��,除體外診斷試劑外�,共涉及《醫(yī)療器械分類目錄》中22個子目錄的產(chǎn)品。
注冊數(shù)量前五位的進口醫(yī)療器械���,主要是:醫(yī)用成像器械����,無源植入器械�,注輸、護理和防護器械�����,口腔科器械��,神經(jīng)和心血管手術(shù)器械�。與2021年相比,注輸����、護理和防護器械類產(chǎn)品取代眼科器械�����,相同類別產(chǎn)品注冊數(shù)量略有增加���。
(五)進口醫(yī)療器械國別情況
2022年,共有28個國家(地區(qū))產(chǎn)品在我國獲批上市����。
其中,美國���、德國�、日本���、韓國��、法國醫(yī)療器械在中國醫(yī)療器械進口產(chǎn)品首次注冊數(shù)量排前5位�,注冊產(chǎn)品數(shù)量約占2022年進口產(chǎn)品首次注冊總數(shù)量的76.4%���,與2021年相比略有增加���。
從進口醫(yī)療器械代理人分布看,共有18個省涉及有本省企業(yè)作為進口醫(yī)療器械代理人�����,其中上海市代理人代理的進口首次醫(yī)療器械數(shù)量最多�,占全部進口醫(yī)療器械數(shù)量的62.4%。
(六)境內(nèi)第三類醫(yī)療器械省份分析
從2022年境內(nèi)第三類醫(yī)療器械注冊情況看��,相關(guān)注冊人主要集中在沿海經(jīng)濟較發(fā)達省份�。
其中,江蘇�、廣東、北京��、上海�����、浙江是境內(nèi)第三類醫(yī)療器械首次注冊數(shù)量排前五名的省份���,占2022年境內(nèi)第三類醫(yī)療器械首次注冊數(shù)量的69.7%��,與2021年相比增加1.8%����。