這周證標(biāo)客服務(wù)的兩家采用醫(yī)療器械注冊(cè)人制度的企業(yè)順利通過藥監(jiān)局體系考核���,在成功服務(wù)浙江省首個(gè)醫(yī)療器械注冊(cè)人制度項(xiàng)目之后,也成功服務(wù)了首個(gè)杭州市余杭區(qū)醫(yī)療器械注冊(cè)人制度項(xiàng)目���??紤]到醫(yī)療器械注冊(cè)人制度的優(yōu)越性�����,及越來越多的客戶咨詢到相關(guān)事項(xiàng)�����,因此���,寫個(gè)文章為大家簡(jiǎn)要介紹我國(guó)醫(yī)療器械注冊(cè)人制度?�����。
這周證標(biāo)客服務(wù)的兩家采用醫(yī)療器械注冊(cè)人制度的企業(yè)順利通過藥監(jiān)局體系考核����,在成功服務(wù)浙江省首個(gè)醫(yī)療器械注冊(cè)人制度項(xiàng)目之后,也成功服務(wù)了首個(gè)杭州市余杭區(qū)醫(yī)療器械注冊(cè)人制度項(xiàng)目�����?��?紤]到醫(yī)療器械注冊(cè)人制度的優(yōu)越性���,及越來越多的客戶咨詢到相關(guān)事項(xiàng),因此�,寫個(gè)文章為大家簡(jiǎn)要介紹我國(guó)醫(yī)療器械注冊(cè)人制度。
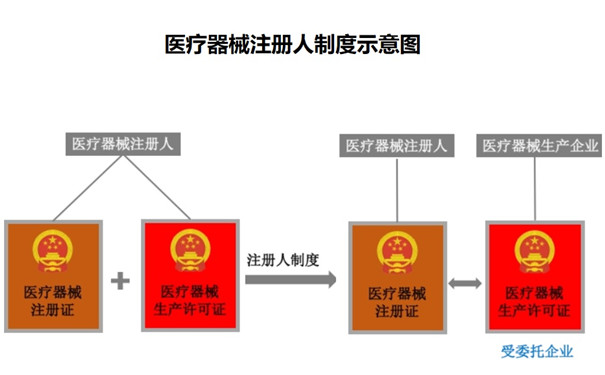
一���、什么是醫(yī)療器械注冊(cè)人制度��?
醫(yī)療器械注冊(cè)人在注冊(cè)申報(bào)以及生產(chǎn)時(shí)可將產(chǎn)品委托給不同的生產(chǎn)商生產(chǎn)���,但注冊(cè)人對(duì)醫(yī)療器械全生命周期負(fù)主體責(zé)任�,這種制度稱為注冊(cè)人制度��。
符合條件的醫(yī)療器械注冊(cè)申請(qǐng)人申請(qǐng)并取得醫(yī)療器械注冊(cè)證后成為醫(yī)療器械注冊(cè)人(簡(jiǎn)稱“注冊(cè)人”)����。其核心要義是注冊(cè)人以自身名義將產(chǎn)品推向市場(chǎng),對(duì)產(chǎn)品全生命周期負(fù)責(zé)���。醫(yī)療器械注冊(cè)人制度將醫(yī)療器械注冊(cè)證和生產(chǎn)許可證進(jìn)行剝離�,醫(yī)療器械注冊(cè)人可以將其注冊(cè)的產(chǎn)品委托給一家或多家滿足要求的生產(chǎn)企業(yè)�����。提到“醫(yī)療器械注冊(cè)人”這個(gè)名詞�����,不得不先來認(rèn)識(shí)另外一個(gè)與之密切相關(guān)的名詞——“上市許可持有人/MAH(Marketing Authorization Holder)”���。2018年8月13日發(fā)布的《醫(yī)療器械不良事件監(jiān)測(cè)和再評(píng)價(jià)管理辦法》,是中國(guó)藥監(jiān)部門第一次在正式法規(guī)文件中使用了“醫(yī)療器械上市許可持有人”這個(gè)稱呼����。其中第四條規(guī)定:醫(yī)療器械上市許可持有人��,是指醫(yī)療器械注冊(cè)證書和醫(yī)療器械備案憑證的持有人�,即醫(yī)療器械注冊(cè)人和備案人���。從定義不難看出�����,醫(yī)療器械上市許可持有人/MAH有兩種類型���,而醫(yī)療器械注冊(cè)人只是其中之一。如果一個(gè)公司僅僅擁有醫(yī)療器械備案憑證(即第一類醫(yī)療器械上市資格)�����,那么它應(yīng)該被稱為“醫(yī)療器械備案人”�����,而不是“醫(yī)療器械注冊(cè)人”����。但是,由于目前醫(yī)療器械行業(yè)內(nèi)通常把焦點(diǎn)放在需要上市審批的產(chǎn)品和企業(yè)上�,所以當(dāng)我們現(xiàn)在提起“上市許可持有人”或“MAH”時(shí)���,通常是默認(rèn)指向醫(yī)療器械注冊(cè)人,而這兩者實(shí)際上是有區(qū)別的��。二���、我國(guó)醫(yī)療器械注冊(cè)人制度發(fā)展歷程:(一)醫(yī)療器械注冊(cè)人制度出現(xiàn)前
2000年�,我國(guó)才擁有了第一部醫(yī)療器械專業(yè)法規(guī)——《醫(yī)療器械監(jiān)督管理?xiàng)l例》�。在此之前我國(guó)的醫(yī)療器械產(chǎn)品大多仿自國(guó)外大型廠商的名牌產(chǎn)品,100%的國(guó)產(chǎn)產(chǎn)品少之又少�。本身是在別人技術(shù)的基礎(chǔ)上進(jìn)行的“二次開發(fā)”,受限于法規(guī)�、專利和版權(quán)的問題,也就不好拿出去委托第三方生產(chǎn)了�。
2000年以后��,隨著國(guó)內(nèi)器械廠商技術(shù)積累的豐富和研發(fā)能力的壯大����,行業(yè)內(nèi)迎來了一段時(shí)間的新產(chǎn)品上市熱。但是���,由于當(dāng)時(shí)我國(guó)基礎(chǔ)領(lǐng)域研究能力仍顯不足����,為保證產(chǎn)品質(zhì)量,很多企業(yè)的設(shè)計(jì)和生產(chǎn)團(tuán)隊(duì)需要頻繁的磨合�����,甚至只能采取邊生產(chǎn)邊改進(jìn)工藝的方式�。注冊(cè)證的持有者不能、也不敢將研發(fā)和制造環(huán)節(jié)輕易地脫鉤����。
2010年以后,特別是2015年以后����,隨著我國(guó)各項(xiàng)基礎(chǔ)研究領(lǐng)域的發(fā)展,研發(fā)和制造管理各領(lǐng)域的參與者也積攢了豐富的實(shí)踐經(jīng)驗(yàn)���,MAH的話題又被行業(yè)內(nèi)的先行者們提了出來�。但是�����,當(dāng)時(shí)由于我國(guó)物權(quán)�、專利權(quán)���、合同、產(chǎn)品質(zhì)量等相關(guān)法律法規(guī)的不健全���,整體市場(chǎng)環(huán)境并不接受MAH這種高信任度的經(jīng)濟(jì)合作模式�����。國(guó)內(nèi)各專業(yè)領(lǐng)域細(xì)分并未形成良好的整體可信度��,再加上企業(yè)自身品控水平不一����、信用良莠不齊����,監(jiān)管部門雖有考慮逐步放開產(chǎn)品上市模式,但始終沒有下定決心�����。
雖然沒有上市許可持有人MAH制度�����,但當(dāng)時(shí)國(guó)內(nèi)企業(yè)還是可以通過委托生產(chǎn)的方式來完成生產(chǎn)方式的轉(zhuǎn)移��。當(dāng)然這個(gè)生產(chǎn)轉(zhuǎn)移是有限的:僅允許企業(yè)在取得產(chǎn)品注冊(cè)(已具備上市許可和生產(chǎn)許可)后���,采取委托生產(chǎn)的方式轉(zhuǎn)移生產(chǎn)環(huán)節(jié)���,同時(shí)要求委托雙方都須具有生產(chǎn)許可資質(zhì)。
這種委托生產(chǎn)的方式不同于前文所說的醫(yī)療器械注冊(cè)人制度����,委托生產(chǎn)是不允許上市申請(qǐng)人以委托的方式取得產(chǎn)品上市許可批準(zhǔn)的。同樣的�����,市場(chǎng)中常見的資格證書轉(zhuǎn)移行為也被禁止�����,監(jiān)管部門也沒有為類似情況留出“政策空間”����。不可否認(rèn)的是,當(dāng)時(shí)的法規(guī)政策限制了一批合理合法完成企業(yè)兼并、重組的行為�,使一部分醫(yī)療器械產(chǎn)品首次上市申請(qǐng)和上市資格轉(zhuǎn)移的訴求得不到主張。
(二)醫(yī)療器械注冊(cè)人制度試點(diǎn)階段
隨著上海邁出了醫(yī)療器械注冊(cè)人試點(diǎn)的第一步�,廣東和天津也陸續(xù)加入到了試點(diǎn)的行列。2019年����,為了更好的收集行業(yè)反饋、擴(kuò)大試點(diǎn)效果�����,國(guó)家藥品監(jiān)督管理局更是將試點(diǎn)范圍擴(kuò)大到了北京��、天津�����、河北���、遼寧���、黑龍江、上海���、江蘇����、浙江���、安徽���、福建、山東�、河南、湖北����、湖南、廣東�����、廣西�、海南、重慶����、四川、云南、陜西等21個(gè)省�����、自治區(qū)�、直轄市。
(三)醫(yī)療器械注冊(cè)人制度全面推廣及法規(guī)體系建設(shè)加速完善
2017年����,中辦、國(guó)辦兩辦發(fā)布《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》���,明確實(shí)施注冊(cè)人制度�,國(guó)家藥監(jiān)局隨后在上海���、廣東����、天津等?����。ㄊ校﹩?dòng)注冊(cè)人制度試點(diǎn)���。2019年��,《關(guān)于進(jìn)一步擴(kuò)大醫(yī)療器械注冊(cè)人制度試點(diǎn)工作的通知》發(fā)布���,試點(diǎn)省份擴(kuò)大到22個(gè)。2021年6月1日新修訂《醫(yī)療器械監(jiān)督管理?xiàng)l例》實(shí)施���,標(biāo)志著注冊(cè)人制度在全國(guó)范圍內(nèi)正式生根落地����。
配套新修訂《條例》實(shí)施�,國(guó)家局在2021年修訂發(fā)布了《醫(yī)療器械注冊(cè)管理辦法》《體外診斷試劑注冊(cè)管理辦法》,今年3月份又修訂發(fā)布了《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》《醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法》�����,并第一時(shí)間配套發(fā)布了《關(guān)于加強(qiáng)醫(yī)療器械跨區(qū)域委托生產(chǎn)協(xié)同監(jiān)管工作的意見》����、《關(guān)于發(fā)布醫(yī)療器械委托生產(chǎn)質(zhì)量協(xié)議編制指南的通告》等一系列配套文件。據(jù)統(tǒng)計(jì)���,截至目前���,我國(guó)已經(jīng)形成了以《醫(yī)療器械監(jiān)督管理?xiàng)l例》為核心����,13部配套規(guī)章�、140余個(gè)配套規(guī)范性文件、490余份技術(shù)指導(dǎo)原則為支撐��,較為完備的全生命周期監(jiān)管法規(guī)體系��。
“我們從法規(guī)體系上進(jìn)一步明確醫(yī)療器械注冊(cè)人����、受托生產(chǎn)企業(yè)的責(zé)任和義務(wù),明確醫(yī)療器械注冊(cè)人對(duì)上市醫(yī)療器械全生命周期的產(chǎn)品質(zhì)量安全依法承擔(dān)責(zé)任要求�。”國(guó)家藥監(jiān)局醫(yī)療器械監(jiān)管司王者雄司長(zhǎng)介紹���,從法規(guī)層面歸納起來有三個(gè)主要特點(diǎn)�����,即:醫(yī)療器械注冊(cè)人對(duì)所上市產(chǎn)品質(zhì)量安全全面負(fù)責(zé)���、受托生產(chǎn)企業(yè)對(duì)生產(chǎn)行為負(fù)責(zé)并接受注冊(cè)人的監(jiān)督���、醫(yī)療器械注冊(cè)人所在地省級(jí)藥品監(jiān)管部門全面負(fù)責(zé)對(duì)醫(yī)療器械注冊(cè)人的監(jiān)督管理。
國(guó)家局還結(jié)合監(jiān)管實(shí)際���,對(duì)原有的《醫(yī)療器械生產(chǎn)企業(yè)分類分級(jí)監(jiān)督管理規(guī)定》��、《醫(yī)療器械經(jīng)營(yíng)企業(yè)分類分級(jí)監(jiān)督管理規(guī)定》進(jìn)行了修訂���,形成了《關(guān)于加強(qiáng)醫(yī)療器械生產(chǎn)經(jīng)營(yíng)分級(jí)監(jiān)管工作的意見》�����,目前正在面向社會(huì)公開征求意見��。
目的是綜合運(yùn)用科學(xué)監(jiān)管���、信用監(jiān)管和智慧監(jiān)管等手段�,全方面多角度加強(qiáng)對(duì)醫(yī)療器械注冊(cè)人和受托生產(chǎn)企業(yè)的監(jiān)管�。”王者雄強(qiáng)調(diào)��,要堅(jiān)決杜絕監(jiān)管盲區(qū)�、消除監(jiān)管漏洞�����,全面指導(dǎo)屬地監(jiān)管部門有效落實(shí)監(jiān)管責(zé)任���,企業(yè)有效落實(shí)產(chǎn)品質(zhì)量安全主體責(zé)任。
杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司是全國(guó)最早開展醫(yī)療器械注冊(cè)人制度咨詢服務(wù)的機(jī)構(gòu)之一�����,任何有關(guān)醫(yī)療器械注冊(cè)人制度相關(guān)咨詢��,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)���,聯(lián)系人:葉工�����,電話:18058734169��,微信同�。