藥監(jiān)審評的時(shí)候����,部分嚴(yán)謹(jǐn)區(qū)域有一套不成文規(guī)則,是植入類器械需要開展動(dòng)物實(shí)驗(yàn)研究����,但因?yàn)椴⒎敲魑囊?guī)定�����,所以執(zhí)行起來不同地區(qū)�����、不同審評老師存在差異�����?����!陡骨粌?nèi)窺鏡手術(shù)系統(tǒng)注冊審查指導(dǎo)原則第2部分:動(dòng)物試驗(yàn)決策判定和要求(征求意見稿)》的制定�����,將幫助統(tǒng)一審評尺度,也幫助醫(yī)療器械注冊人提前預(yù)見風(fēng)險(xiǎn)�����,合理規(guī)劃項(xiàng)目���。
藥監(jiān)審評的時(shí)候�,部分嚴(yán)謹(jǐn)區(qū)域有一套不成文規(guī)則�����,是植入類器械需要開展動(dòng)物實(shí)驗(yàn)研究��,但因?yàn)椴⒎敲魑囊?guī)定����,所以執(zhí)行起來不同地區(qū)、不同審評老師存在差異��?���!?span style="text-wrap: wrap;">腹腔內(nèi)窺鏡手術(shù)系統(tǒng)注冊審查指導(dǎo)原則第2部分:動(dòng)物試驗(yàn)決策判定和要求(征求意見稿)》的制定�,將幫助統(tǒng)一審評尺度�����,也幫助醫(yī)療器械注冊人提前預(yù)見風(fēng)險(xiǎn)�,合理規(guī)劃項(xiàng)目。
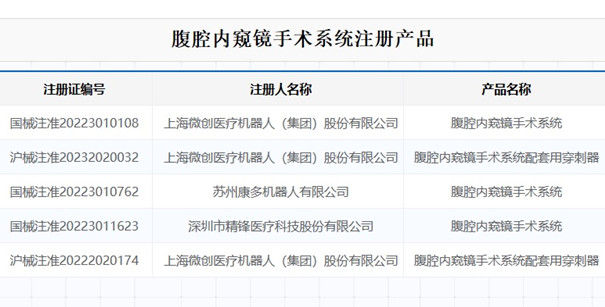
腹腔內(nèi)窺鏡手術(shù)系統(tǒng)注冊審查指導(dǎo)原則第2部分:動(dòng)物試驗(yàn)決策判定和要求
(征求意見稿)
本指導(dǎo)原則旨在為技術(shù)審評部門審評腹腔內(nèi)窺鏡手術(shù)系統(tǒng)(也稱手術(shù)機(jī)器人)申報(bào)資料提供參考,同時(shí)也用于指導(dǎo)注冊申請人對申報(bào)資料的準(zhǔn)備及撰寫。
本指導(dǎo)原則是供醫(yī)療器械注冊申請人和審評人員使用的指導(dǎo)文件��,不涉及注冊審批等行政事項(xiàng),亦不作為法規(guī)強(qiáng)制執(zhí)行����,如有能夠滿足法規(guī)要求的其他方法�����,也可以采用��,但應(yīng)提供詳細(xì)的研究資料和驗(yàn)證資料�����。應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則���。
本指導(dǎo)原則是在現(xiàn)行法規(guī)��、標(biāo)準(zhǔn)體系及當(dāng)前認(rèn)知水平下制定的��,隨著法規(guī)��、標(biāo)準(zhǔn)體系的不斷完善和科學(xué)技術(shù)的不斷發(fā)展��,本指導(dǎo)原則相關(guān)內(nèi)容也將適時(shí)進(jìn)行調(diào)整����。
一、適用范圍
本指導(dǎo)原則適用于多孔的腹腔內(nèi)窺鏡手術(shù)系統(tǒng)的動(dòng)物試驗(yàn)設(shè)計(jì)與實(shí)施�,旨在指導(dǎo)注冊申請人科學(xué)地開展手術(shù)機(jī)器人動(dòng)物試驗(yàn)研究,不適用于在非活體動(dòng)物���、離體組織或器官上進(jìn)行的研究���。
二、決策開展動(dòng)物試驗(yàn)的原則
注冊申請人決策利用動(dòng)物試驗(yàn)開展內(nèi)窺鏡手術(shù)系統(tǒng)的安全性����、有效性評價(jià)時(shí),可參考《醫(yī)療器械動(dòng)物試驗(yàn)研究技術(shù)審查指導(dǎo)原則第一部分:決策原則》(2021年修訂版)���。
在申報(bào)產(chǎn)品的設(shè)計(jì)開發(fā)階段���,注冊申請人應(yīng)當(dāng)對內(nèi)窺鏡手術(shù)系統(tǒng)開展性能和安全評估����,且經(jīng)過適當(dāng)?shù)娘L(fēng)險(xiǎn)分析評估后��,再?zèng)Q策開展動(dòng)物試驗(yàn)�。對于風(fēng)險(xiǎn)評估后決策需要開展動(dòng)物試驗(yàn)的情況,若需要開展臨床試驗(yàn)���,動(dòng)物試驗(yàn)應(yīng)在臨床試驗(yàn)前完成��。
該類產(chǎn)品的結(jié)構(gòu)組成通常包括醫(yī)生控制臺、患者手術(shù)平臺���、影像處理平臺及配套使用的手術(shù)器械等����。因此需要整體考量試驗(yàn)?zāi)康?��,同時(shí)根據(jù)申報(bào)產(chǎn)品的實(shí)際情況決策開展動(dòng)物試驗(yàn)��。決策需要開展動(dòng)物試驗(yàn)用于評估手術(shù)機(jī)器人安全性�、有效性、可操控性的研究至少包括以下情形:
(一)無前代產(chǎn)品或產(chǎn)品迭代的首次注冊的手術(shù)機(jī)器人����。
(二)已獲證的手術(shù)機(jī)器人,
1.產(chǎn)品結(jié)構(gòu)組成不發(fā)生變化��,適用范圍中增加新的臨床術(shù)式應(yīng)用于不同的組織類型/解剖結(jié)構(gòu)����,如在泌尿外科的基礎(chǔ)上增加普外科/婦科/胸外科手術(shù)等。
2.產(chǎn)品結(jié)構(gòu)組成新增手術(shù)器械����,且工作原理、手術(shù)操作(例:吻合與剪切)與原手術(shù)器械相比差異較大�,如原結(jié)構(gòu)組成中配套使用的手術(shù)器械為無源手術(shù)器械,變更注冊新增與手術(shù)機(jī)器人配套使用的高頻手術(shù)器械/吻合器/超聲刀等�。
3.患者手術(shù)平臺機(jī)械臂數(shù)量的發(fā)生變化,應(yīng)開展動(dòng)物試驗(yàn)評價(jià)變更后的安全性和有效性����。
4.適用范圍中新增非手術(shù)操作系統(tǒng)的功能且無法通過臺架試驗(yàn)來驗(yàn)證安全性和有效性,如通過更換成像組件/軟件升級實(shí)現(xiàn)增加熒光成像功能����;
5.已有手術(shù)器械適用范圍發(fā)生變化�����,如新增超聲刀與原型號相比閉合血管尺寸發(fā)生變化��,應(yīng)評價(jià)該器械在相兼容的原手術(shù)機(jī)器人工作平臺上的安全性和有效性����,至少包括實(shí)際閉合效果���、可處理血管尺寸�����、術(shù)后愈合��、術(shù)中出血�、不良事件(需著重關(guān)注側(cè)向熱損傷和術(shù)后出血)等����。
6.通過升級手術(shù)機(jī)器人主機(jī)的軟件/機(jī)械功能改變了操控性能的設(shè)計(jì)�,如腕部結(jié)構(gòu)���、傳動(dòng)方式發(fā)生設(shè)計(jì)變更和力反饋等,可能會影響手術(shù)器械的安全性和有效性��,應(yīng)單獨(dú)評價(jià)器械的匹配性和操控性��,如外科操作的手術(shù)效果����。
(三)其他產(chǎn)品設(shè)計(jì)變更導(dǎo)致操控性能發(fā)生變化。
三�����、動(dòng)物試驗(yàn)研究方案設(shè)計(jì)
動(dòng)物試驗(yàn)可以為臨床試驗(yàn)的方案提供依據(jù)����,預(yù)測在臨床試驗(yàn)中可能出現(xiàn)的不良事件,降低受試者和使用者承擔(dān)的風(fēng)險(xiǎn)���。動(dòng)物試驗(yàn)還可作為臨床評價(jià)的支持性資料�����。注冊申請人在決定利用動(dòng)物試驗(yàn)開展手術(shù)機(jī)器人的安全性����、有效性評價(jià)時(shí),可參考《醫(yī)療器械動(dòng)物試驗(yàn)研究技術(shù)審查指導(dǎo)原則第二部分:試驗(yàn)設(shè)計(jì)����、實(shí)施質(zhì)量保證》。
手術(shù)機(jī)器人的動(dòng)物試驗(yàn)設(shè)計(jì)應(yīng)從安全性����、有效性、可操控性等角度考慮明確試驗(yàn)?zāi)康?����、類型��、方法�、評價(jià)指標(biāo)、手術(shù)過程���、試驗(yàn)結(jié)果及結(jié)論分析等����,形成完整的研究方案���。
由于手術(shù)機(jī)器人的操作者的學(xué)習(xí)曲線存在一定的個(gè)體差異��,建議設(shè)置培訓(xùn)課程(如試驗(yàn)動(dòng)物的解剖要點(diǎn)��、操控臺控制方式��、用戶界面介紹�、穿刺孔安排���、縫合打結(jié)訓(xùn)練����、術(shù)中操作注意事項(xiàng)等)����,建議設(shè)計(jì)預(yù)試驗(yàn)并完成可行性研究后開展正式試驗(yàn)。
(一)動(dòng)物種屬及術(shù)式的選擇
注冊申請人應(yīng)當(dāng)根據(jù)申報(bào)產(chǎn)品的適用范圍����,充分考慮試驗(yàn)的典型性,明確動(dòng)物種屬(豬����、犬等)的選擇依據(jù)���。可參考國家衛(wèi)健委發(fā)布的診療技術(shù)臨床應(yīng)用管理系列規(guī)范��,從手術(shù)難度分級�、基本操作、目標(biāo)組織類型���、申報(bào)的手術(shù)器械等因素確定典型術(shù)式���,例:
通過實(shí)施豬子宮切除術(shù)/雙側(cè)附件切除術(shù)代表婦科手術(shù);通過實(shí)施豬一側(cè)腎臟部分或全部切除術(shù)代表上尿路外科手術(shù)�����;犬前列腺切除術(shù)代表下尿路外科手術(shù)�����;通過實(shí)施豬直腸及遠(yuǎn)端胃切除術(shù)代表胃腸外科手術(shù)�;通過實(shí)施豬的肝部分切除(包含膽囊切除)代表肝膽外科手術(shù);通過實(shí)施豬一側(cè)的肺葉/肺段切除代表胸外科手術(shù)�。以胃腸外科和肝膽外科的手術(shù)代表普外科手術(shù)����。申請人可按照上述典型術(shù)式開展動(dòng)物試驗(yàn)����,若采取其他術(shù)式��,需論證其合理性�。
動(dòng)物試驗(yàn)應(yīng)盡可能涵蓋所有外科基本操作,通常包括:抓持���、切開�����、分離���、牽拉、剝離����、止血、結(jié)扎�����、縫合、剪切�、血管閉合、空腔臟器吻合��、組織的凝閉等�。評價(jià)的動(dòng)物組織(若有)至少涵蓋:系膜、網(wǎng)膜�����、韌帶��、肌肉����、筋膜、脂肪結(jié)締組織��、血管��、淋巴管(結(jié))����、實(shí)質(zhì)臟器(肝臟���、腎臟、肺��、前列腺等)���、空腔臟器(消化道���、泌尿道�、生殖道)等,組織類型應(yīng)根據(jù)申報(bào)產(chǎn)品的擬申報(bào)的適用范圍選擇����。
(二)方案設(shè)計(jì)
可設(shè)對照組,注冊申請人可以選擇已上市手術(shù)機(jī)器人或選擇腹腔內(nèi)窺鏡下的術(shù)式比對�����。若選擇已上市手術(shù)機(jī)器人作為對照組���,兩組配套使用的操作器械的工作原理����、作用機(jī)理、性能參數(shù)應(yīng)當(dāng)相同/相似���,且涵蓋申報(bào)產(chǎn)品結(jié)構(gòu)組成中的手術(shù)器械��。其他手術(shù)器械��、試驗(yàn)材料及耗材��、試驗(yàn)藥品�、術(shù)前準(zhǔn)備���、術(shù)中監(jiān)測�、手術(shù)操作過程��、術(shù)后護(hù)理及處理��、再手術(shù)(若有)��、試驗(yàn)結(jié)果統(tǒng)計(jì)及分析等也應(yīng)平行對照����。如,兩組均同時(shí)使用能量類/無源類手術(shù)器械,鈦夾數(shù)量及位置應(yīng)大致相同等���。
若不設(shè)對照組�,可適當(dāng)增加每種代表術(shù)式的數(shù)量�。應(yīng)明確安全性有效性評價(jià)指標(biāo)的確定依據(jù),可以是已有的公開發(fā)表的文獻(xiàn)��、經(jīng)驗(yàn)數(shù)據(jù)等�����。
應(yīng)描述實(shí)驗(yàn)動(dòng)物種屬���、性別、年齡�、體重、來源�����,飼養(yǎng)及處理方式�。動(dòng)物數(shù)量可按照試驗(yàn)設(shè)計(jì)需求自行設(shè)定,應(yīng)明確數(shù)量的確定理由或依據(jù)�、分組原則,如選擇的動(dòng)物模型對于產(chǎn)品應(yīng)用于人體的安全有效性分析具有局限性���,應(yīng)對研究結(jié)果的影響進(jìn)行詳細(xì)說明����。
若產(chǎn)品結(jié)構(gòu)組成包含能量類手術(shù)器械,動(dòng)物試驗(yàn)應(yīng)能觀察到產(chǎn)品作用于動(dòng)物之前����、之后不同時(shí)間點(diǎn)的大體組織狀態(tài),研究中選擇的觀察時(shí)間點(diǎn)應(yīng)有合理依據(jù)����。由于動(dòng)物模型和人體之間組織損傷與愈合應(yīng)答存在差異以及不同手術(shù)器械能量參數(shù)設(shè)置存在差異性,因此應(yīng)合理評估安全性�、有效性的最終觀察時(shí)間點(diǎn),應(yīng)充分考慮評估術(shù)前����、術(shù)中、術(shù)后的組織狀態(tài)����。
評估試驗(yàn)過程應(yīng)滿足動(dòng)物試驗(yàn)方法學(xué)的需要,若試驗(yàn)組與對照組設(shè)備的工作原理相同/相似���,評估標(biāo)準(zhǔn)及觀察時(shí)間點(diǎn)應(yīng)統(tǒng)一��。
試驗(yàn)之前應(yīng)對操作人員進(jìn)行充分的培訓(xùn)��,使其充分了解配套使用的手術(shù)器械各工作模式(設(shè)置參數(shù))的選擇原則�,在試驗(yàn)時(shí),由操作者針對靶器官/組織情況選取適當(dāng)?shù)墓ぷ髂J剑ㄔO(shè)置參數(shù))��。應(yīng)對病理評價(jià)/閱片者設(shè)盲�����,病理學(xué)評價(jià)的人員應(yīng)具有相應(yīng)的資質(zhì)��。試驗(yàn)組和對照組(若有)試驗(yàn)應(yīng)由相同操作者進(jìn)行���,且操作者應(yīng)當(dāng)進(jìn)行充分培訓(xùn)���。
手術(shù)機(jī)器人的動(dòng)物試驗(yàn)設(shè)計(jì)��,原則上在同一只動(dòng)物只能完成一種手術(shù)方式���,若需實(shí)施多個(gè)臟器切除術(shù)��,應(yīng)說明多個(gè)臟器切除術(shù)的場景與依據(jù)�����,并滿足典型術(shù)式的完整性��、合理性�。
(三)手術(shù)操作系統(tǒng)的評價(jià)
通常應(yīng)包含安全性、有效性�����、可操控性等評價(jià)指標(biāo)��。
1. 安全性����,試驗(yàn)研究中建議盡可能對相關(guān)的不良事件進(jìn)行觀察,并統(tǒng)計(jì)發(fā)生率��,評價(jià)綜合并發(fā)癥�����。至少包括:
在不發(fā)生術(shù)中不良事件的情況下進(jìn)行手術(shù)的能力��,是否因產(chǎn)品功能失效對非靶組織、非靶器官造成損傷����,是否引起血管損傷導(dǎo)致嚴(yán)重出血、組織修補(bǔ)�����;是否引起嚴(yán)重大出血危及生命��;生存期內(nèi)(3-4周)生命體征�����、實(shí)驗(yàn)室檢查��、圍手術(shù)期并發(fā)癥發(fā)生情況�,如術(shù)后大出血、吻合口瘺����、腹腔感染、膽漏和尿漏等��;手術(shù)操作系統(tǒng)及手術(shù)器械故障發(fā)生情況��。如果安全性評價(jià)指標(biāo)與本導(dǎo)則不同����,應(yīng)當(dāng)給出設(shè)定依據(jù)并評估能否滿足安全性觀察終點(diǎn)。
手術(shù)中安全性評價(jià)應(yīng)注意觀察各種與安全性相關(guān)的問題或事件����,應(yīng)包含但不限于以下內(nèi)容:器械彎折或斷裂、閉合不嚴(yán)����、絕緣層破裂、器械移動(dòng)旋轉(zhuǎn)偏擺失效����、主從控制系統(tǒng)異常斷開、能量平臺激發(fā)失效��、內(nèi)窺鏡系統(tǒng)顯示故障�、機(jī)械臂互相碰撞,如皮下氣腫����、氣體栓塞、氣胸���、高碳酸血癥��、酸中毒等�。
2. 有效性,應(yīng)當(dāng)設(shè)計(jì)主要評價(jià)指標(biāo)和次要評價(jià)指標(biāo)�。
主要評價(jià)指標(biāo)可為動(dòng)物存活狀態(tài)下順利完成試驗(yàn)?zāi)康牡谋壤m樌瓿扇糠桨冈O(shè)計(jì)中的手術(shù)操作且術(shù)后動(dòng)物存活至圍手術(shù)期視為手術(shù)成功�,未順利完成原手術(shù)方案設(shè)計(jì)中機(jī)器人系統(tǒng)完成的全部操作,術(shù)中因大出血���、器械故障�����、系統(tǒng)故障等意外情況中轉(zhuǎn)成腔鏡手術(shù)或開腹手術(shù)�����,視為手術(shù)失敗���。
次要評價(jià)指標(biāo)至少包括:成像質(zhì)量、手術(shù)時(shí)間���、術(shù)中出血量��、手術(shù)失敗比例等�����。
手術(shù)機(jī)器人成像質(zhì)量的評價(jià)可參考《醫(yī)用內(nèi)窺鏡臨床評價(jià)體系專家共識》中的評價(jià)指標(biāo)設(shè)定�����,此外還應(yīng)對3D成像性能(若有)���、熒光成像能力(若有)進(jìn)行驗(yàn)證。
3. 可操控性的評價(jià)可采用主觀評價(jià)����,但指標(biāo)應(yīng)量化且具備實(shí)操性、適用性���。至少應(yīng)包括:(1)醫(yī)生及患者手術(shù)平臺的人體工程學(xué)設(shè)計(jì)性能�,可參考YY/T 1474�、YY/T 9706.106 、FDA指南Applying Human Factors and Usability Engineering to Medical Devices制訂�。
(2)手術(shù)操作系統(tǒng)性能:包括主從操作、機(jī)械臂運(yùn)動(dòng)�、用戶接口易用特性��、各手術(shù)器械與手術(shù)操作系統(tǒng)聯(lián)合使用性能��、控制平臺與影像處理平臺的圖像移動(dòng)一致性�����、器械移動(dòng)的平順性和夾持的穩(wěn)定性等�����。
4.手術(shù)器械的評價(jià)
與手術(shù)操作系統(tǒng)配合使用的非能量類及能量類的手術(shù)器械通常應(yīng)評價(jià)可用性�����,能量類還應(yīng)評價(jià)安全性�����、有效性����。手術(shù)器械靈活性�,應(yīng)驗(yàn)證典型術(shù)式的全部基本操作。
可操控性應(yīng)當(dāng)側(cè)重于驗(yàn)證手術(shù)操作系統(tǒng)對的手術(shù)器械控制的評價(jià)。除典型術(shù)式的全部基本操作外���,還應(yīng)根據(jù)各自由度的圖示���,評價(jià)手術(shù)器械實(shí)現(xiàn)的自由度數(shù)量��、各自由度的運(yùn)動(dòng)方向����、運(yùn)動(dòng)范圍等是否能滿足預(yù)期臨床需求。
能量類手術(shù)器械的評價(jià)可通過動(dòng)物試驗(yàn)開展量效關(guān)系和熱損傷的研究����。可參考相關(guān)專用指導(dǎo)原則對動(dòng)物試驗(yàn)的要求�,如《超聲軟組織手術(shù)設(shè)備注冊技術(shù)審查指導(dǎo)原則》(2023年修訂版)、《高頻手術(shù)設(shè)備注冊技術(shù)審查指導(dǎo)原則》(2023年修訂版)����、《腔鏡用吻合器產(chǎn)品注冊技術(shù)審查指導(dǎo)原則》、《手術(shù)電極產(chǎn)品注冊技術(shù)審查指導(dǎo)原則》等��。
手術(shù)器械的評價(jià)可通過分析評估后選取典型性型號進(jìn)行驗(yàn)證��。例1,確定典型術(shù)式后��,同一非能量類的手術(shù)器械有多個(gè)不同的設(shè)計(jì)��,可選擇結(jié)構(gòu)最復(fù)雜��、自由度最多����、末端執(zhí)行器位姿空間(角度、距離)最大的型號作為最不利情況進(jìn)行動(dòng)物試驗(yàn)����。例2,已獲證的手術(shù)機(jī)器人��,產(chǎn)品結(jié)構(gòu)組成新增能量類的手術(shù)器械的型號���,且工作原理�����、作用機(jī)理與原型號相同/相似��。如新增雙極鉗型號與原型號相比頭端部尺寸變化����,可單獨(dú)評價(jià)頭端部大小/形狀/輪廓、抓持力�����、開口角度��、運(yùn)動(dòng)范圍等���。
5.試驗(yàn)結(jié)果及結(jié)論
應(yīng)對手術(shù)操作系統(tǒng)及手術(shù)器械的試驗(yàn)結(jié)果進(jìn)行整體評價(jià)并提供完整的研究報(bào)告。審評主要關(guān)注的是各組生存期內(nèi)各評價(jià)指標(biāo)的試驗(yàn)結(jié)果及其分析��,試驗(yàn)及對照組設(shè)備偏差�����、管理偏差�,評價(jià)偏差對試驗(yàn)結(jié)果的影響。熱損傷報(bào)告應(yīng)提供高質(zhì)量的彩色圖像�����,并應(yīng)清楚標(biāo)明損傷區(qū)域邊緣及測量方法����。根據(jù)分析結(jié)果匯總結(jié)論�,系統(tǒng)評價(jià)可操控性��、安全性��、有效性�。
四、試驗(yàn)報(bào)告
動(dòng)物試驗(yàn)報(bào)告應(yīng)包括但不限于以下內(nèi)容:動(dòng)物模型選擇依據(jù)簡介�、試驗(yàn)的質(zhì)量保證聲明及相關(guān)證明資料、試驗(yàn)?zāi)康?�、試?yàn)計(jì)劃�����、試驗(yàn)材料�����、試驗(yàn)組及對照組(若有)情況���、其他試驗(yàn)用設(shè)備和機(jī)器及藥品情況���、試驗(yàn)結(jié)果及結(jié)論����。
試驗(yàn)計(jì)劃中應(yīng)詳述樣本量或動(dòng)物的數(shù)量及分組��,評價(jià)指標(biāo)及評價(jià)標(biāo)準(zhǔn)���。應(yīng)對試驗(yàn)環(huán)境�����、試驗(yàn)步驟進(jìn)行描述���,明確試驗(yàn)組準(zhǔn)備、動(dòng)物準(zhǔn)備�、手術(shù)方法����、手術(shù)部位、術(shù)前準(zhǔn)備等����。應(yīng)對手術(shù)過程進(jìn)行詳細(xì)描述。
試驗(yàn)結(jié)果描述應(yīng)清晰����,結(jié)論應(yīng)明確�。如�����,完成了***手術(shù)�,未發(fā)生與器械相關(guān)的不良事件;這些結(jié)果顯示���,采用***手術(shù)機(jī)器人可以安全有效地完成***手術(shù)�����。
注冊申請人應(yīng)當(dāng)保證手術(shù)機(jī)器人動(dòng)物試驗(yàn)數(shù)據(jù)的真實(shí)性和科學(xué)性負(fù)責(zé)���,實(shí)施與質(zhì)量保證的具體要求應(yīng)當(dāng)符合《醫(yī)療器械動(dòng)物試驗(yàn)研究注冊審查指導(dǎo)原則第二部分:試驗(yàn)設(shè)計(jì)、實(shí)施質(zhì)量保證》中的要求��。
五�、參考文獻(xiàn)
[1]秦川,魏泓.實(shí)驗(yàn)動(dòng)物學(xué)第二版[M].北京:人民衛(wèi)生出版社,2015.
[2]《超聲軟組織手術(shù)設(shè)備注冊技術(shù)審查指導(dǎo)原則》(2023年修訂版)(2023年第4號通告)
[3]《腔鏡用吻合器產(chǎn)品注冊技術(shù)審查指導(dǎo)原則》(2017年第44號通告)
[4] General Considerations for Animal Studies for Medical Devices [EB].(Draft Guidance)
[5]《醫(yī)療器械動(dòng)物試驗(yàn)研究技術(shù)審查指導(dǎo)原則第一部分:決策原則(2021年修訂版)》(2021年第75號通告)
[6]《醫(yī)療器械動(dòng)物試驗(yàn)研究注冊審查指導(dǎo)原則第二部分:試驗(yàn)設(shè)計(jì)、實(shí)施質(zhì)量保證》(2021年第75號通告)
[7]《高頻手術(shù)設(shè)備注冊技術(shù)審查指導(dǎo)原則》(2016年第21號通告)
[8]YY/T1754.1-2020醫(yī)療器械臨床前動(dòng)物研究第1部分:通用要求
[9]GB/T35823-2018實(shí)驗(yàn)動(dòng)物 動(dòng)物實(shí)驗(yàn)通用要求
[10]醫(yī)用內(nèi)窺鏡臨床評價(jià)體系專家共識 [J].中國肺癌雜志2020年6月第2 3卷第6期
六��、起草單位
國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評中心