《神經(jīng)和肌肉刺激器用體內(nèi)電極注冊(cè)審查指導(dǎo)原則(征求意見稿)》旨在指導(dǎo)醫(yī)療器械注冊(cè)申請(qǐng)人對(duì)神經(jīng)和肌肉刺激器用體內(nèi)電極(以下簡(jiǎn)稱刺激器用體內(nèi)電極)注冊(cè)申報(bào)資料的準(zhǔn)備及撰寫,同時(shí)也為技術(shù)審評(píng)部門審評(píng)注冊(cè)申報(bào)資料提供參考����。本指導(dǎo)原則是對(duì)刺激器用體內(nèi)電極注冊(cè)申報(bào)資料的一般要求,申請(qǐng)人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中的內(nèi)容是否適用�����。
神經(jīng)和肌肉刺激器用體內(nèi)電極注冊(cè)審查指導(dǎo)原則(征求意見稿)
本指導(dǎo)原則旨在指導(dǎo)醫(yī)療器械注冊(cè)申請(qǐng)人對(duì)神經(jīng)和肌肉刺激器用體內(nèi)電極(以下簡(jiǎn)稱刺激器用體內(nèi)電極)注冊(cè)申報(bào)資料的準(zhǔn)備及撰寫���,同時(shí)也為技術(shù)審評(píng)部門審評(píng)注冊(cè)申報(bào)資料提供參考�����。
本指導(dǎo)原則是對(duì)刺激器用體內(nèi)電極注冊(cè)申報(bào)資料的一般要求��,申請(qǐng)人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中的內(nèi)容是否適用���。若不適用�,需具體闡述其理由及相應(yīng)的科學(xué)依據(jù)����,并依據(jù)具體的產(chǎn)品特性對(duì)注冊(cè)申報(bào)資料的內(nèi)容進(jìn)行充實(shí)和細(xì)化。
本指導(dǎo)原則是供注冊(cè)申請(qǐng)人和技術(shù)審評(píng)人員使用的指導(dǎo)性文件��,但不包括注冊(cè)審批所涉及的行政事項(xiàng)��,亦不作為法規(guī)強(qiáng)制執(zhí)行��,應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則�。如果有能夠滿足相關(guān)法規(guī)要求的其他方法,也可以采用���,但是需要提供詳細(xì)的研究資料和驗(yàn)證資料���。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制定的,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善���,以及科學(xué)技術(shù)的不斷發(fā)展����,相關(guān)內(nèi)容也將適時(shí)進(jìn)行調(diào)整�����。
一�、適用范圍
本指導(dǎo)原則適用于通過(guò)作用于人體腔道(陰道和直腸)內(nèi),將主機(jī)發(fā)出的電刺激電流傳導(dǎo)至人體��,或?qū)⑷梭w局部的電信號(hào)反饋至主機(jī)的神經(jīng)和肌肉刺激器用體內(nèi)電極����。根據(jù)《醫(yī)療器械分類目錄》(總局2017年第104號(hào)公告),該類產(chǎn)品分類編碼為09-01-05(物理治療器械-電療設(shè)備/器具-神經(jīng)和肌肉刺激器用電極)����,管理類別為II類。
本指導(dǎo)原則僅適用于符合YY9706.210規(guī)定�����、用于盆底肌功能評(píng)估和康復(fù)訓(xùn)練的神經(jīng)和肌肉刺激器類設(shè)備使用的附件電極��,電針�����、毫針、中醫(yī)探穴功能的電極不適用于本指導(dǎo)原則�,帶有壓力信號(hào)傳導(dǎo)功能的刺激器用體內(nèi)電極、配合電超聲治療儀設(shè)備使用的刺激器用體內(nèi)電極也不適用于本指導(dǎo)原則���,但可參照本指導(dǎo)原則適用的相關(guān)條款執(zhí)行���。
二、注冊(cè)審查要點(diǎn)
(一)監(jiān)管信息
1.產(chǎn)品名稱
產(chǎn)品的命名應(yīng)符合《醫(yī)療器械通用名稱命名規(guī)則》的要求�,采用《醫(yī)療器械分類目錄》、《物理治療器械通用名稱命名指導(dǎo)原則》或國(guó)家標(biāo)準(zhǔn)�����、行業(yè)標(biāo)準(zhǔn)中的通用名稱�����,例如:一次性使用陰道電極���、陰道電極����、一次性使用無(wú)菌陰道電極、直腸電極等�,核心詞盡量避免使用“探頭”“訓(xùn)練器”“訓(xùn)練裝置”等不規(guī)范用語(yǔ)。
2.注冊(cè)單元?jiǎng)澐值脑瓌t和實(shí)例
刺激器用體內(nèi)電極的注冊(cè)單元原則上以產(chǎn)品的使用形式�����、作用部位�����、性能指標(biāo)作為劃分依據(jù)�����。
2.1產(chǎn)品使用形式不同的刺激器用體內(nèi)電極應(yīng)劃分為不同的注冊(cè)單元��。如一次性使用刺激器用體內(nèi)電極和重復(fù)使用刺激器用體內(nèi)電極應(yīng)劃分為不同的注冊(cè)單元���。
2.2產(chǎn)品作用部位不同的刺激器用體內(nèi)電極應(yīng)劃分為不同的醫(yī)療器械注冊(cè)單元。如陰道電極和直腸電極應(yīng)劃分為不同的注冊(cè)單元���。
2.3主要性能指標(biāo)不能覆蓋��、有較大差異的�����,應(yīng)劃分為不同的注冊(cè)單元����。
(二)綜述資料
1.概述
描述申報(bào)產(chǎn)品的名稱及其確定依據(jù)、管理類別和分類編碼���、適用范圍等相關(guān)信息�����。如適用�,描述有關(guān)申報(bào)產(chǎn)品的背景信息概述或特別細(xì)節(jié)��,如:申報(bào)產(chǎn)品的歷史概述���、歷次提交的信息�����,與其他經(jīng)批準(zhǔn)上市產(chǎn)品的關(guān)系等��。
2.產(chǎn)品描述
2.1工作原理
刺激器用體內(nèi)電極一般不具備單獨(dú)的臨床功能����,它放置于患者體內(nèi),臨床上配合主機(jī)用于盆底肌功能的評(píng)估和康復(fù)訓(xùn)練�。
刺激器用體內(nèi)電極通常可具備采集生物反饋信號(hào)功能�����,患者主動(dòng)收縮和放松時(shí)盆底肌群會(huì)產(chǎn)生肌電信號(hào)��,肌電信號(hào)通過(guò)連接線反饋至主機(jī)�����,主機(jī)針對(duì)采集傳輸?shù)募‰娦盘?hào)進(jìn)行分析處理�����,用于評(píng)估患者的盆底肌狀態(tài)��。
主機(jī)可發(fā)出≤1000Hz的電刺激信號(hào)����,并通過(guò)連接線傳導(dǎo)至電極作用于患者,從而完成對(duì)盆底肌功能的康復(fù)訓(xùn)練�。
2.2產(chǎn)品的結(jié)構(gòu)和組成
2 .2.1刺激器用體內(nèi)電極一般由基體、導(dǎo)電部分��、電極線組成�����。
刺激器用體內(nèi)電極按作用部位可分為陰道電極���、直腸電極���,如圖所示。
陰道電極按通道數(shù)可分為單通道電極和雙通道電極���,如圖所示�����。
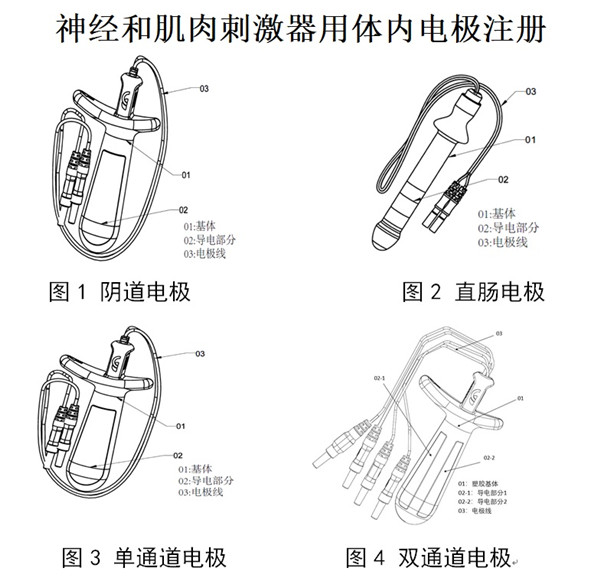
單通道電極具有1對(duì)導(dǎo)電電極片��,一般對(duì)整個(gè)盆底肌功能進(jìn)行評(píng)估或康復(fù)訓(xùn)練����。雙通道電極具有2對(duì)導(dǎo)電電極片,配合具有對(duì)稱性評(píng)估功能模塊的神經(jīng)和肌肉刺激器主機(jī)使用����,可分別評(píng)估陰道左右壁的肌肉生理功能狀態(tài)差異,從而針對(duì)患側(cè)進(jìn)行精準(zhǔn)治療���。這里所說(shuō)的患側(cè)指的是肌肉生理功能受損的一側(cè)����。
2.2.2組成單元結(jié)構(gòu)/功能描述
(1)基體:電極基體用于包裹電極導(dǎo)電部分及導(dǎo)電部分與電極線的連接部分���,電極基體一般為塑料或其他高分子材料���。
(2)電極線:主要用于神經(jīng)和肌肉刺激器主機(jī)與電極導(dǎo)電部分之間的連接,將人體局部的肌電信號(hào)由電極導(dǎo)電部分傳導(dǎo)至主機(jī)��,同時(shí)將主機(jī)的電刺激信號(hào)傳導(dǎo)至電極導(dǎo)電部分���,作用于人體自然腔道。
(3)導(dǎo)電部分:盆底肌肉收縮和放松時(shí)產(chǎn)生的肌電信號(hào)�,通過(guò)電極的導(dǎo)電部分經(jīng)電極線傳導(dǎo)至主機(jī),同時(shí)將主機(jī)發(fā)出的電刺激信號(hào)經(jīng)過(guò)電極線傳導(dǎo)至電極的導(dǎo)電部分�����,經(jīng)導(dǎo)電部分將電刺激信號(hào)傳導(dǎo)至盆底肌肉,形成對(duì)盆底肌肉的電刺激���。
2.3型號(hào)規(guī)格
對(duì)于存在多種型號(hào)規(guī)格的產(chǎn)品�,應(yīng)當(dāng)明確各型號(hào)規(guī)格的區(qū)別�����。應(yīng)當(dāng)采用對(duì)比表或帶有說(shuō)明性文字的圖片��、圖表�,描述各種型號(hào)規(guī)格的結(jié)構(gòu)組成(或配置)、功能����、產(chǎn)品特征和導(dǎo)電部分尺寸等技術(shù)參數(shù)內(nèi)容。
2.4包裝說(shuō)明
(1)說(shuō)明刺激器用體內(nèi)電極的包裝信息��。如刺激器用體內(nèi)電極為無(wú)菌形式提供��,應(yīng)當(dāng)說(shuō)明其無(wú)菌屏障系統(tǒng)的信息�����;如神經(jīng)和肌肉刺激器用體內(nèi)電極具有微生物限度要求,應(yīng)當(dāng)說(shuō)明保持其微生物限度的包裝信息��;說(shuō)明如何確保最終使用者可清晰地辨識(shí)包裝的完整性��。
(2)若使用者在進(jìn)行滅菌前需要包裝����,應(yīng)當(dāng)提供正確包裝的信息(如材料、成分和尺寸等)����。
2.5研發(fā)歷程、與同類和/或前代產(chǎn)品的參考和比較
綜述同類產(chǎn)品/前代產(chǎn)品的現(xiàn)狀及發(fā)展趨勢(shì)�,描述本次申報(bào)產(chǎn)品與已上市同類產(chǎn)品/前代產(chǎn)品的創(chuàng)新點(diǎn)、相似點(diǎn)和不同點(diǎn)����,建議以列表的方式表述,比較的項(xiàng)目應(yīng)至少包括產(chǎn)品名稱�、型號(hào)規(guī)格、工作原理����、結(jié)構(gòu)組成�����、導(dǎo)電材質(zhì)、使用形式����、使用部位及導(dǎo)通電阻等關(guān)鍵的性能指標(biāo)。
3.適用范圍和禁忌證
3.1適用范圍
適用范圍可表述為:在醫(yī)療機(jī)構(gòu)中與適配的神經(jīng)和肌肉刺激器主機(jī)配合使用���,在主機(jī)和治療部位間傳遞信號(hào)��,用于盆底肌功能的評(píng)估和康復(fù)訓(xùn)練��。專用型刺激器用體內(nèi)電極還需明確特定配合使用的設(shè)備信息����,如產(chǎn)品名稱�����、型號(hào)規(guī)格�、生產(chǎn)商信息等。
3.2預(yù)期使用環(huán)境
刺激器用體內(nèi)電極通常在醫(yī)療機(jī)構(gòu)中����、由專業(yè)醫(yī)務(wù)人員操作使用�,申請(qǐng)人應(yīng)當(dāng)明確可能影響其安全性和有效性的環(huán)境條件��,如溫度�����、濕度����、壓力、移動(dòng)��、振動(dòng)�、海拔等。
3.3適用人群
與神經(jīng)和肌肉刺激器主機(jī)適用人群一致���。
3.4禁忌證
禁忌證包括但不限于以下內(nèi)容:
a) 嚴(yán)重認(rèn)知障礙患者�;
b) 惡性腫瘤患者����;
c) 癲癇患者;
d) 孕婦��;
e) 植入式電子裝置(例如心臟起搏器);
f) 急性化膿炎癥����、出血傾向��、血栓性靜脈炎����、活動(dòng)性肺結(jié)核、治療部位有金屬異物的患者�����;
g) 材質(zhì)過(guò)敏人群���;
h) 電極接觸表面局部皮膚黏膜破損等�����。
i) 參考配合使用的神經(jīng)和肌肉刺激器主機(jī)的禁忌證內(nèi)容�。
4.產(chǎn)品的不良事件歷史記錄
申請(qǐng)人在風(fēng)險(xiǎn)分析時(shí)應(yīng)關(guān)注同品種醫(yī)療器械產(chǎn)品的不良事件歷史記錄�。
查詢FDA產(chǎn)品全生命周期數(shù)據(jù)庫(kù)(TPLC Database)和國(guó)家藥品評(píng)價(jià)中心網(wǎng)站的醫(yī)療器械不良事件信息通報(bào)和警戒快訊,與刺激器用體內(nèi)電極相關(guān)的器械故障分別為電極開裂����、漏電流�����、連接處彎曲�、信號(hào)不穩(wěn)定����、無(wú)信號(hào)傳輸?shù)取?duì)于患者的不良影響包含:暈厥���、抽搐��、紅斑���、異物感、疼痛��、引起皮膚過(guò)敏���、肌肉痙攣等�����。
5.其他需要說(shuō)明的內(nèi)容
應(yīng)說(shuō)明與神經(jīng)和肌肉刺激器主機(jī)組合使用的方式���、存在的物理電氣連接方式�、明確特定配合使用的設(shè)備信息等�����。
(三)非臨床資料
1.產(chǎn)品風(fēng)險(xiǎn)管理資料
申請(qǐng)人參照GB/T 42062《醫(yī)療器械 風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》中的規(guī)定��,并結(jié)合產(chǎn)品本身的特點(diǎn)對(duì)產(chǎn)品風(fēng)險(xiǎn)進(jìn)行全生命周期的管理����。風(fēng)險(xiǎn)管理活動(dòng)要貫穿產(chǎn)品設(shè)計(jì)����、生產(chǎn)、上市后使用及產(chǎn)品處理的整個(gè)生命周期����。風(fēng)險(xiǎn)管理報(bào)告可包含風(fēng)險(xiǎn)分析、風(fēng)險(xiǎn)評(píng)價(jià)�����、風(fēng)險(xiǎn)控制、風(fēng)險(xiǎn)監(jiān)測(cè)�����,應(yīng)符合有關(guān)要求��,審查要點(diǎn)包括:
1.1是否正確識(shí)別醫(yī)療器械預(yù)期用途和與安全有關(guān)特征�����;
1.2是否系統(tǒng)識(shí)別正常和故障兩種條件下的可預(yù)見危險(xiǎn)(源)�;
1.3是否利用風(fēng)險(xiǎn)管理計(jì)劃中規(guī)定的可接受性準(zhǔn)則,對(duì)風(fēng)險(xiǎn)進(jìn)行評(píng)價(jià)并進(jìn)行風(fēng)險(xiǎn)控制��,也包括綜合剩余風(fēng)險(xiǎn)的可接受性評(píng)價(jià)��。
附件中表1給出了產(chǎn)品常見的風(fēng)險(xiǎn)要素及示例���。由于不同產(chǎn)品的工作原理���、結(jié)構(gòu)組成、性能指標(biāo)存在差異��,所以這些風(fēng)險(xiǎn)要素并不是全部���,申請(qǐng)人還應(yīng)根據(jù)產(chǎn)品特點(diǎn)確定其他風(fēng)險(xiǎn)并進(jìn)行有效控制�����。
2.醫(yī)療器械安全和性能基本原則清單
說(shuō)明產(chǎn)品符合《醫(yī)療器械安全和性能基本原則清單》各項(xiàng)適用要求所采用的方法�����,以及證明其符合性的文件��。對(duì)于不適用的各項(xiàng)要求����,應(yīng)當(dāng)說(shuō)明理由���。
3.產(chǎn)品技術(shù)要求
3.1產(chǎn)品適用的相關(guān)標(biāo)準(zhǔn)
下列標(biāo)準(zhǔn)可以應(yīng)用于本文件���。
表2產(chǎn)品適用的相關(guān)標(biāo)準(zhǔn)
GB 9706.1 | 《醫(yī)用電氣設(shè)備 第1部分:基本安全和基本性能的通用要求》 |
YY 9706.102 | 《醫(yī)用電氣設(shè)備 第1-2部分:基本安全和基本性能的通用要求 并列標(biāo)準(zhǔn):電磁兼容 要求和試驗(yàn)》 |
YY 9706.210 | 《醫(yī)用電氣設(shè)備 第2-10部分:神經(jīng)和肌肉刺激器的基本安全和基本性能專用要求》 |
YY 9706.240 | 《醫(yī)用電氣設(shè)備 第2-40部分:肌電及誘發(fā)反應(yīng)設(shè)備的基本安全和基本性能專用要求》 |
GB/T 16886.1 | 《醫(yī)療器械生物學(xué)評(píng)價(jià) 第1部分:風(fēng)險(xiǎn)管理過(guò)程中的評(píng)價(jià)與試驗(yàn)》 |
GB/T 16886.5 | 《醫(yī)療器械生物學(xué)評(píng)價(jià) 第5部分:體外細(xì)胞毒性試驗(yàn)》 |
GB/T 16886.7 | 《醫(yī)療器械生物學(xué)評(píng)價(jià) 第7部分:環(huán)氧乙烷滅菌殘留量》 |
GB/T 16886.10 | 《醫(yī)療器械生物學(xué)評(píng)價(jià) 第10部分:刺激與皮膚致敏試驗(yàn)》 |
YY/T 0868 | 《神經(jīng)和肌肉刺激器用電極》 |
上述標(biāo)準(zhǔn)包括了產(chǎn)品技術(shù)要求中經(jīng)常涉及到的通用標(biāo)準(zhǔn)和方法標(biāo)準(zhǔn)?�?筛鶕?jù)產(chǎn)品的特點(diǎn)增加相關(guān)要求�����。
產(chǎn)品引用標(biāo)準(zhǔn)的審查可以分兩步來(lái)進(jìn)行。首先對(duì)引用標(biāo)準(zhǔn)的齊全性�、適宜性和準(zhǔn)確性來(lái)進(jìn)行審查。此時(shí)��,應(yīng)注意標(biāo)準(zhǔn)編號(hào)��、標(biāo)準(zhǔn)名稱是否完整規(guī)范�,年代號(hào)是否有效。
其次是對(duì)引用標(biāo)準(zhǔn)的采納情況進(jìn)行審查�。即所引用的標(biāo)準(zhǔn)中適用的條款要求是否在產(chǎn)品技術(shù)要求中進(jìn)行實(shí)質(zhì)性的條款引用。這種引用通常采用兩種方式:文字表述繁多���、內(nèi)容復(fù)雜的可以直接引用標(biāo)準(zhǔn)及條文號(hào)����;文字比較簡(jiǎn)單的可以直接引述具體要求�����。
3.2產(chǎn)品技術(shù)要求
注冊(cè)申請(qǐng)人應(yīng)按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》編寫產(chǎn)品技術(shù)要求���。
本條款給出需要考慮的產(chǎn)品主要技術(shù)指標(biāo)�����,如有附加功能���,注冊(cè)申請(qǐng)人應(yīng)采用相應(yīng)的標(biāo)準(zhǔn)��,具體可結(jié)合注冊(cè)申請(qǐng)人自身的技術(shù)能力���,參考相應(yīng)的國(guó)家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)�。注冊(cè)申請(qǐng)人如不采用以下條款(包括國(guó)家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)要求)���,應(yīng)當(dāng)說(shuō)明理由。
3.2.1尺寸規(guī)格
應(yīng)規(guī)定電極導(dǎo)電部分尺寸規(guī)格和電極連接線尺寸規(guī)格的具體數(shù)值����,其誤差應(yīng)不超過(guò)標(biāo)稱值的±5%。
3.2.2性能
3.2.2.1測(cè)量靈敏度
參照YY/T1095����,規(guī)定測(cè)量靈敏度相關(guān)要求。
3.2.2.2導(dǎo)通電阻
應(yīng)規(guī)定電極的導(dǎo)電阻抗范圍����,并在隨機(jī)文件中聲稱相關(guān)數(shù)值��。
3.2.2.3隔離電阻(絕緣阻抗)
應(yīng)根據(jù)產(chǎn)品實(shí)際���,規(guī)定其限值,應(yīng)大于10 MΩ�����。
3.2.2.4無(wú)菌
無(wú)菌包裝的電極應(yīng)經(jīng)過(guò)已確認(rèn)過(guò)的滅菌過(guò)程使產(chǎn)品無(wú)菌�����。
3.2.2.5環(huán)氧乙烷殘留量
采用環(huán)氧乙烷滅菌的電極����,其環(huán)氧乙烷殘留量應(yīng)不大于10μg/g。
3.2.2.6微生物
一次性使用非無(wú)菌包裝電極的細(xì)菌菌落總數(shù)應(yīng)不大于20cfu/g�,大腸菌群、致病性化膿菌和真菌菌落不得檢出�����。
3.2.3外觀
電極外觀應(yīng)平整光潔��,修邊整齊��,導(dǎo)電部分顏色應(yīng)均勻。
3.2.4安全要求
應(yīng)符合GB 9706.1����、YY 9706.102、YY 9706.210��、YY 9706.240的要求��。
4.產(chǎn)品檢驗(yàn)報(bào)告
4.1注冊(cè)申請(qǐng)人應(yīng)提供產(chǎn)品檢驗(yàn)報(bào)告�����,產(chǎn)品檢驗(yàn)報(bào)告應(yīng)符合國(guó)務(wù)院藥品監(jiān)督管理部門的要求�,可以是醫(yī)療器械注冊(cè)申請(qǐng)人的自檢報(bào)告,也可以是委托具有醫(yī)療器械檢驗(yàn)資質(zhì)的醫(yī)療器械檢驗(yàn)機(jī)構(gòu)出具的檢驗(yàn)報(bào)告��。
4.2典型產(chǎn)品應(yīng)是同一注冊(cè)單元內(nèi)能夠代表本單元內(nèi)其他產(chǎn)品安全性和有效性的產(chǎn)品�����,應(yīng)考慮功能最齊全�、結(jié)構(gòu)最復(fù)雜�、風(fēng)險(xiǎn)最高的產(chǎn)品,并提交典型性聲明�。
4.3注冊(cè)單元內(nèi)各種型號(hào)產(chǎn)品的主要安全指標(biāo)�����、性能指標(biāo)不能被某一型號(hào)產(chǎn)品全部涵蓋時(shí)����,則應(yīng)選擇涵蓋安全指標(biāo)�����、性能指標(biāo)最多的型號(hào)作為典型產(chǎn)品����,同時(shí)還應(yīng)考慮其他產(chǎn)品中未被典型型號(hào)所涵蓋的安全指標(biāo)及性能指標(biāo)。
5.研究資料
5.1化學(xué)和物理性能研究
應(yīng)當(dāng)提供刺激器用體內(nèi)電極性能研究資料以及產(chǎn)品技術(shù)要求的研究和編制說(shuō)明���,包括功能性����、安全性指標(biāo)以及與質(zhì)量控制相關(guān)的其他指標(biāo)的確定依據(jù)�,所采用的標(biāo)準(zhǔn)或方法、采用原因及理論基礎(chǔ)�。刺激器用體內(nèi)電極的性能研究可參照YY/T 0868,若有不采納的條款,應(yīng)說(shuō)明不適用的理由���。此外建議增加以下研究?jī)?nèi)容:
5.1.1電極放置要求
應(yīng)當(dāng)提供刺激器用體內(nèi)電極放置示意圖���。提供進(jìn)入體內(nèi)部分結(jié)構(gòu)尺寸(外徑或?qū)挾取㈤L(zhǎng)度)����、進(jìn)入人體部分應(yīng)當(dāng)停止的位置及相關(guān)尺寸設(shè)計(jì)的依據(jù)等
5.1.2聯(lián)合使用
因刺激器用體內(nèi)電極預(yù)期與神經(jīng)和肌肉刺激器主機(jī)聯(lián)合使用實(shí)現(xiàn)同一預(yù)期用途,應(yīng)當(dāng)提供證明聯(lián)合使用安全有效的研究資料�����,包括互聯(lián)基本信息(連接類型��、接口���、最低性能)�、聯(lián)合使用風(fēng)險(xiǎn)及控制措施�、聯(lián)合使用上的限制、兼容性研究等��。
5.1.3連接線穩(wěn)定性研究
刺激器用體內(nèi)電極預(yù)期與配合使用的神經(jīng)和肌肉刺激器主機(jī)連接�,如電極預(yù)期可重復(fù)使用,應(yīng)對(duì)連接線進(jìn)行穩(wěn)定性研究����,可通過(guò)插拔試驗(yàn)、彎折試驗(yàn)等方式驗(yàn)證在最大重復(fù)使用次數(shù)或使用期限內(nèi)連接線的穩(wěn)定性�。
5.2電氣系統(tǒng)安全性研究
應(yīng)當(dāng)提供電氣安全性、機(jī)械和環(huán)境保護(hù)以及電磁兼容性的研究資料����,說(shuō)明適用的標(biāo)準(zhǔn)以及開展的研究,并提供與主機(jī)的連接要求����、隔離電阻、電介質(zhì)強(qiáng)度等研究資料��。
5.3生物學(xué)特性研究
生物相容性評(píng)價(jià)應(yīng)對(duì)成品中預(yù)期與人體接觸的部分而不是原材料進(jìn)行評(píng)價(jià)���。根據(jù)預(yù)期用途明確電極與人體接觸的部位��、接觸性質(zhì)��、接觸時(shí)間以及接觸材料的種類���。根據(jù)接觸性質(zhì)�����、接觸時(shí)間�、材料的種類等信息選擇合適的評(píng)價(jià)方式開展評(píng)價(jià)研究��。應(yīng)注意�,預(yù)期接觸陰道,生物學(xué)評(píng)價(jià)還應(yīng)包含陰道刺激�;預(yù)期接觸直腸,生物學(xué)評(píng)價(jià)還應(yīng)包含直腸刺激���?�;砻馍飳W(xué)試驗(yàn)���,應(yīng)論證合理理由。
如需進(jìn)行生物相容性試驗(yàn)���,應(yīng)按照GB/T 16886系列標(biāo)準(zhǔn)的要求開展��,至少包括以下方面的要求:細(xì)胞毒性��、致敏反應(yīng)�����、陰道或直腸刺激�����。
5.4清潔�、消毒����、滅菌研究
(1)刺激器用體內(nèi)電極如為無(wú)菌提供,可根據(jù)產(chǎn)品材質(zhì)不同��,選擇合適的滅菌方法�����,并應(yīng)當(dāng)明確滅菌工藝(方法和參數(shù))和無(wú)菌保證水平(SAL)�����,并提供滅菌驗(yàn)證及確認(rèn)的相關(guān)研究資料���。
(2)刺激器用體內(nèi)電極如為使用者滅菌����,應(yīng)當(dāng)明確推薦的滅菌工藝(方法和參數(shù))、所推薦滅菌工藝的確定依據(jù)以及驗(yàn)證的相關(guān)研究資料�����;對(duì)可耐受兩次或多次滅菌的產(chǎn)品����,應(yīng)當(dāng)提供產(chǎn)品所推薦滅菌工藝耐受性的研究資料。
(3)刺激器用體內(nèi)電極通常為使用者消毒����,因刺激器用體內(nèi)電極與黏膜相接觸,建議采用高水平消毒方式�����,應(yīng)當(dāng)明確推薦的消毒工藝及工藝的確定依據(jù)��,消毒工藝包含消毒劑的類型�����、濃度和有效的作用時(shí)間等��,并應(yīng)提供消毒效果及消毒耐受性的驗(yàn)證資料。
(4)若刺激器用體內(nèi)電極經(jīng)滅菌或消毒后可能產(chǎn)生殘留物質(zhì),應(yīng)當(dāng)對(duì)滅菌或消毒后的刺激器用體內(nèi)電極進(jìn)行殘留毒性的研究��,明確殘留物信息及采取的處理方法�����,并提供相關(guān)研究資料��。
(5)若刺激器用體內(nèi)電極以非無(wú)菌狀態(tài)交付��,且使用前需滅菌����,應(yīng)當(dāng)提供證明包裝能減少產(chǎn)品受到微生物污染的風(fēng)險(xiǎn)�,且適用于生產(chǎn)企業(yè)規(guī)定滅菌方法的研究資料。
5.5穩(wěn)定性研究
5.5.1貨架有效期
應(yīng)當(dāng)提供貨架有效期和包裝研究資料�,證明在貨架有效期內(nèi),在注冊(cè)申請(qǐng)人規(guī)定的運(yùn)輸貯存條件下�����,產(chǎn)品可保持性能功能滿足使用要求���,具有微生物限度要求的產(chǎn)品還應(yīng)當(dāng)符合微生物限度要求�,以無(wú)菌狀態(tài)交付的產(chǎn)品還應(yīng)保持無(wú)菌狀態(tài)。
5.5.2使用穩(wěn)定性
重復(fù)性使用的刺激器用體內(nèi)電極應(yīng)參考《有源醫(yī)療器械使用期限注冊(cè)技術(shù)審查指導(dǎo)原則》���,結(jié)合清洗消毒滅菌工藝對(duì)產(chǎn)品的影響����,提供使用穩(wěn)定性/可靠性研究資料����,建議在老化/疲勞及消毒滅菌耐受性試驗(yàn)后對(duì)電氣安全、關(guān)鍵性能進(jìn)行驗(yàn)證����,如導(dǎo)通電阻、隔離電阻�、電介質(zhì)強(qiáng)度等,以此證明在生產(chǎn)企業(yè)規(guī)定的使用期限(或最大使用次數(shù))內(nèi)���,在正常使用情況下��,產(chǎn)品的性能功能滿足使用要求���。
5.5.3運(yùn)輸穩(wěn)定性
注冊(cè)申請(qǐng)人應(yīng)當(dāng)提供運(yùn)輸穩(wěn)定性和包裝研究資料,證明在生產(chǎn)企業(yè)規(guī)定的運(yùn)輸條件下,運(yùn)輸過(guò)程中的環(huán)境條件(例如:振動(dòng)��、溫度和濕度的波動(dòng))不會(huì)對(duì)產(chǎn)品的特性和性能�����,包括完整性和清潔度�����,造成不利影響�?���?蓞⒖枷嚓P(guān)標(biāo)準(zhǔn)進(jìn)行論述,例如可參考標(biāo)準(zhǔn)GB/T 14710�����,試驗(yàn)后需對(duì)關(guān)鍵性能進(jìn)行驗(yàn)證���,如導(dǎo)通電阻����、隔離電阻��、電介質(zhì)強(qiáng)度等。
5.6可用性相關(guān)研究
可參照人因設(shè)計(jì)與可用性相關(guān)指導(dǎo)原則����,開展可用性研究,并提供相應(yīng)的研究資料�����。
(四)臨床評(píng)價(jià)資料
該類產(chǎn)品不屬于《免于臨床評(píng)價(jià)醫(yī)療器械目錄》內(nèi)產(chǎn)品���,按照《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》《決策是否開展醫(yī)療器械臨床試驗(yàn)技術(shù)指導(dǎo)原則》等要求提供刺激器用體內(nèi)電極產(chǎn)品的臨床評(píng)價(jià)資料����。采取同品種對(duì)比路徑對(duì)產(chǎn)品進(jìn)行臨床評(píng)價(jià)�,可參考《醫(yī)療器械臨床評(píng)價(jià)等同性論證技術(shù)指導(dǎo)原則》等文件提供相關(guān)資料。采取臨床試驗(yàn)路徑進(jìn)行臨床評(píng)價(jià)�����,參考《醫(yī)療器械臨床試驗(yàn)數(shù)據(jù)遞交要求注冊(cè)審查指導(dǎo)原則》《醫(yī)療器械臨床試驗(yàn)設(shè)計(jì)指導(dǎo)原則》《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》等規(guī)范性文件提交相關(guān)資料���。
(五)產(chǎn)品說(shuō)明書和標(biāo)簽要求
產(chǎn)品說(shuō)明書和標(biāo)簽的編寫應(yīng)符合《醫(yī)療器械說(shuō)明書和標(biāo)簽管理規(guī)定》��、GB9706.1����、YY/T 0868及相關(guān)標(biāo)準(zhǔn)的規(guī)定,一般應(yīng)包括以下要求����。
1.說(shuō)明書
說(shuō)明書應(yīng)清晰、簡(jiǎn)潔����,應(yīng)使用中文且易于理解的簡(jiǎn)單詞語(yǔ),結(jié)構(gòu)嚴(yán)整����,易于閱讀���,盡量使用符號(hào)或圖示�����。一般應(yīng)包括以下內(nèi)容:
1.1產(chǎn)品名稱:明確產(chǎn)品名稱�、產(chǎn)品型號(hào)���、規(guī)格及其代表的意義����。
1.2給出注冊(cè)人的名稱、住所�、聯(lián)系方式及售后服務(wù)單位。
1.3給出生產(chǎn)企業(yè)的名稱�、住所、生產(chǎn)地址����、聯(lián)系方式及生產(chǎn)許可證書編號(hào),委托生產(chǎn)的還應(yīng)當(dāng)標(biāo)注受托企業(yè)的名稱��、住所����、生產(chǎn)地址、生產(chǎn)許可證編號(hào)����。
1.4給出醫(yī)療器械注冊(cè)證編號(hào)及產(chǎn)品技術(shù)要求編號(hào)。
1.5產(chǎn)品性能:參照產(chǎn)品技術(shù)要求審查����。
1.6主要結(jié)構(gòu)組成:注冊(cè)申請(qǐng)人應(yīng)規(guī)定產(chǎn)品的結(jié)構(gòu)組成���,應(yīng)有產(chǎn)品和配件的圖示和說(shuō)明。
1.7產(chǎn)品適用范圍及禁忌證��,參照臨床評(píng)價(jià)資料及綜述資料審查���。
1.8注意事項(xiàng)�����、警示及提示內(nèi)容:應(yīng)按照《醫(yī)療器械說(shuō)明書和標(biāo)簽管理規(guī)定》��、YY/T 0868的要求進(jìn)行審查�。
1.9安裝和使用說(shuō)明:注冊(cè)申請(qǐng)人應(yīng)明確產(chǎn)品的使用方法�����。
1.10保養(yǎng)及維護(hù)方法:注冊(cè)申請(qǐng)人應(yīng)給出產(chǎn)品維護(hù)和保養(yǎng)及定期檢查的方法���;若有可由用戶自行排除的故障,則應(yīng)說(shuō)明故障的種類和產(chǎn)生的原因及排除方法等���。
1.11運(yùn)輸條件:注冊(cè)申請(qǐng)人應(yīng)根據(jù)產(chǎn)品特性�����,明確運(yùn)輸方法及條件�����。
1.12儲(chǔ)存條件:注冊(cè)申請(qǐng)人應(yīng)根據(jù)產(chǎn)品特性�,明確儲(chǔ)存環(huán)境要求。
1.13應(yīng)明確生產(chǎn)日期�����、使用期限及在預(yù)期使用及維護(hù)條件下的定期檢查時(shí)間�����。
1.14應(yīng)明確產(chǎn)品配件清單����,包括配件、附屬品��、損耗品更換周期及更換方法的說(shuō)明����。
1.15應(yīng)參照相關(guān)國(guó)家標(biāo)準(zhǔn)及行業(yè)標(biāo)準(zhǔn)中的規(guī)定��,給出產(chǎn)品標(biāo)簽所用的圖形�����、符號(hào)��、縮寫等內(nèi)容的解釋��。
1.16清潔消毒或滅菌方法:注冊(cè)申請(qǐng)人應(yīng)根據(jù)其產(chǎn)品情況列出產(chǎn)品的清潔消毒或滅菌的方法�����,參照研究資料審查��。
1.17明確說(shuō)明書的編制和修訂日期�。
1.18按照YY/T 0868中的要求提供相關(guān)信息����。
1.19除上述要求外,應(yīng)在說(shuō)明書中明確以下信息:產(chǎn)品在使用前確認(rèn)是否與設(shè)備適配����,并列明適配主機(jī)的信息��;刺激器用體內(nèi)電極應(yīng)為專人專用,避免交叉感染����;治療部位有傷口時(shí)應(yīng)避免使用;首次使用時(shí)�,產(chǎn)品需在包裝完好的情況下方可正常使用;電極線插口嚴(yán)禁接觸液體,否則會(huì)導(dǎo)致接觸不良�;其他特殊使用說(shuō)明。
產(chǎn)品說(shuō)明書的內(nèi)容均應(yīng)有明確的來(lái)源����,與綜述資料、研究資料等注冊(cè)申報(bào)資料的內(nèi)容保持一致�����。說(shuō)明書中涉及技術(shù)內(nèi)容且前述注冊(cè)申報(bào)資料中未包含的�,建議提交相應(yīng)驗(yàn)證資料。
2.標(biāo)簽
刺激器用體內(nèi)電極產(chǎn)品的標(biāo)簽應(yīng)符合《醫(yī)療器械說(shuō)明書和標(biāo)簽管理規(guī)定》���、GB9706.1�、YY/T 0868�����、YY/T 0466.1及相關(guān)標(biāo)準(zhǔn)的要求。
刺激器用體內(nèi)電極產(chǎn)品的標(biāo)簽因位置或者大小受限而無(wú)法全部標(biāo)明上述內(nèi)容的�,至少應(yīng)當(dāng)標(biāo)注產(chǎn)品名稱、型號(hào)��、規(guī)格�、生產(chǎn)日期和使用期限或者失效日期,并在標(biāo)簽中明確“其他內(nèi)容詳見說(shuō)明書”�����,如使用的符號(hào)沒有現(xiàn)有的標(biāo)準(zhǔn)��,應(yīng)該在刺激器用體內(nèi)電極產(chǎn)品的相關(guān)文件中對(duì)這些符號(hào)進(jìn)行說(shuō)明�。
(六)質(zhì)量管理體系文件
1.生產(chǎn)工藝過(guò)程及過(guò)程控制點(diǎn)
應(yīng)當(dāng)根據(jù)刺激器用體內(nèi)電極的實(shí)際情況,可以流程圖的形式對(duì)生產(chǎn)工藝過(guò)程進(jìn)行詳細(xì)描述����,明確產(chǎn)品生產(chǎn)的工藝過(guò)程,以及各關(guān)鍵工藝的控制點(diǎn)����。注明關(guān)鍵工藝和特殊過(guò)程,說(shuō)明過(guò)程控制點(diǎn)及控制標(biāo)準(zhǔn)�����。
2.研發(fā)和生產(chǎn)場(chǎng)地
注冊(cè)申請(qǐng)人應(yīng)當(dāng)對(duì)與刺激器用體內(nèi)電極有關(guān)的研制場(chǎng)地和生產(chǎn)場(chǎng)地情況進(jìn)行概述,如地址����、位置����、面積、生產(chǎn)環(huán)境條件�、生產(chǎn)設(shè)備、工藝裝備�����、監(jiān)視和測(cè)量裝置����、人員等。
三���、參考文獻(xiàn)
[1] 中華人民共和國(guó)國(guó)務(wù)院.醫(yī)療器械監(jiān)督管理?xiàng)l例:中華人民共和國(guó)國(guó)務(wù)院令第739號(hào)[Z].
[2] 國(guó)家市場(chǎng)監(jiān)督管理總局.醫(yī)療器械注冊(cè)與備案管理辦法:國(guó)家市場(chǎng)監(jiān)督管理總局令第47號(hào)[Z].
[3] 國(guó)家食品藥品監(jiān)督管理總局.醫(yī)療器械說(shuō)明書和標(biāo)簽管理規(guī)定:國(guó)家食品藥品監(jiān)督管理總局令第6號(hào)[Z].
[4] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則:國(guó)家藥監(jiān)局通告2022年第8號(hào)[Z].
[5] 國(guó)家食品藥品監(jiān)督管理局.醫(yī)療器械通用名稱命名規(guī)則:國(guó)家食品藥品監(jiān)督管理總局令第19號(hào)[Z].
[6] 國(guó)家藥品監(jiān)督管理局.免于臨床評(píng)價(jià)醫(yī)療器械目錄:國(guó)家藥監(jiān)局通告2021年第71號(hào)[Z].
[7] 國(guó)家食品藥品監(jiān)督管理局.醫(yī)療器械分類目錄:國(guó)家食品藥品監(jiān)督管理總局公告2017年第104號(hào)[Z].
[8] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則:國(guó)家藥監(jiān)局通告2021年第73號(hào)[Z].
[9] 國(guó)家藥品監(jiān)督管理局.決策是否開展醫(yī)療器械臨床試驗(yàn)技術(shù)指導(dǎo)原則:國(guó)家藥監(jiān)局通告2021年第73號(hào)[Z].
[10] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械臨床評(píng)價(jià)等同性論證技術(shù)指導(dǎo)原則:國(guó)家藥監(jiān)局通告2021年第73號(hào)[Z].
[11] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械注冊(cè)申報(bào)臨床評(píng)價(jià)報(bào)告技術(shù)指導(dǎo)原則:國(guó)家藥監(jiān)局通告2021年第73號(hào)[Z].
[12] 國(guó)家藥品監(jiān)督管理局.列入免于臨床評(píng)價(jià)醫(yī)療器械目錄產(chǎn)品對(duì)比說(shuō)明技術(shù)指導(dǎo)原則:國(guó)家藥監(jiān)局通告2021年第73號(hào)[Z].
[13] 國(guó)家藥品監(jiān)督管理局.有源醫(yī)療器械使用期限注冊(cè)技術(shù)審查指導(dǎo)原則:國(guó)家藥品監(jiān)督管理局通告2019年第23號(hào)[Z].
[14] GB 9706.1-2020, 醫(yī)用電氣設(shè)備 第1部分:基本安全和基本性能的通用要求[S].
[15] YY 9706.102-2021����,醫(yī)用電氣設(shè)備 第1-2部分:基本安全和基本性能的通用要求 并列標(biāo)準(zhǔn):電磁兼容 要求和試驗(yàn)[S].
[16] YY 9706.240-2021,醫(yī)用電氣設(shè)備 第2-40部分:肌電及誘發(fā)反應(yīng)設(shè)備的基本安全和基本性能專用要求[S].
[17] YY 9706.210-2021��,醫(yī)用電氣設(shè)備 第2-10部分:神經(jīng)和肌肉刺激器的基本安全和基本性能專用要求[S].
[18] GB/T 16886.1 -2022, 醫(yī)療器械生物學(xué)評(píng)價(jià) 第1部分:風(fēng)險(xiǎn)管理過(guò)程中的評(píng)價(jià)與試驗(yàn)[S].
[19] GB/T 16886.5-2017, 醫(yī)療器械生物學(xué)評(píng)價(jià) 第5部分:體外細(xì)胞毒性試驗(yàn)[S].
[20] GB/T 16886.10-2017, 醫(yī)療器械生物學(xué)評(píng)價(jià) 第10部分:刺激與皮膚致敏試驗(yàn)[S].
[21] YY/T 0868-2021����,神經(jīng)和肌肉刺激器用電極[S].