2024年5月15日����,為幫助和指導(dǎo)醫(yī)療器械注冊申請人做好一次性使用血管內(nèi)導(dǎo)管鞘申報資料準備,進一步規(guī)范相關(guān)產(chǎn)品審評工作���,上海器審中心組織制定了《一次性使用血管內(nèi)導(dǎo)管鞘注冊審評指南》��,一起來學習�、了解一次性使用血管內(nèi)導(dǎo)管鞘注冊要點。
2024年5月15日���,為幫助和指導(dǎo)醫(yī)療器械注冊申請人做好一次性使用血管內(nèi)導(dǎo)管鞘申報資料準備�,進一步規(guī)范相關(guān)產(chǎn)品審評工作��,上海器審中心組織制定了《一次性使用血管內(nèi)導(dǎo)管鞘注冊審評指南》���,一起來學習����、了解一次性使用血管內(nèi)導(dǎo)管鞘注冊要點���。
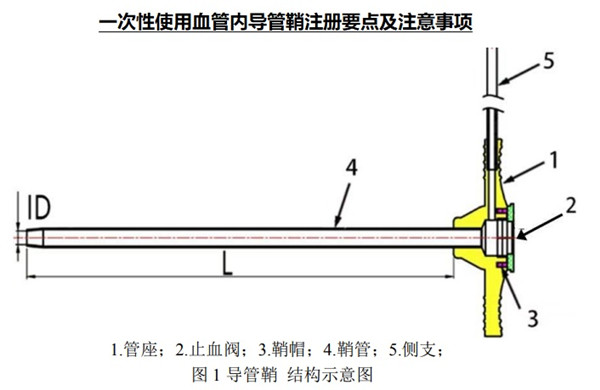
一次性使用血管內(nèi)導(dǎo)管鞘產(chǎn)品與擴張器配合使用�,用于將導(dǎo)絲���、導(dǎo)管等醫(yī)療器械插入血管���。無菌提供��,一次性使用�����。
1.產(chǎn)品描述
1.1 器械及操作原理描述
描述申報產(chǎn)品工作原理�、作用機理(如適用)�����、結(jié)構(gòu)及組成�����、原材料�、交付狀態(tài)及滅菌方式,結(jié)構(gòu)示意圖和/或產(chǎn)品圖示�、使用方法及圖示(如適用)以及區(qū)別于其他同類產(chǎn)品的特征等內(nèi)容。
1.2 結(jié)構(gòu)組成
產(chǎn)品通常由鞘管���、管座和側(cè)支等組件組成,可帶有止血閥等���。需明確產(chǎn)品的結(jié)構(gòu)組成(包括附件)���,并提供產(chǎn)品軸向剖面圖和橫截面圖�����,在圖示中標識各部件的名稱��、尺寸信息及測量位置�����。如鞘管采用多層結(jié)構(gòu)設(shè)計����,橫截面圖上宜體現(xiàn)多層結(jié)構(gòu)����;如鞘管不同節(jié)段材料不同或纏繞/編織方式不同,軸向剖面圖上需標明各節(jié)段長度����。如產(chǎn)品表面有涂層,需明確涂層的預(yù)期用途��、涂層成分���、涂層特征(例如親水或疏水)����、涂覆位置(例如近端或遠端)、涂覆范圍以及涂層的涂覆原理及方式��。如鞘管含有顯影環(huán)�,宜明確顯影環(huán)的位置(距遠端的距離)。
1.3 組成材料
明確產(chǎn)品所有部件(包括附件)組成材料的通用名稱/化學名稱�����、商品名/牌號(若有)����、CAS 號(若有)、生產(chǎn)商����、供應(yīng)商、符合的材料標準(如適用)等基本信息����,提交原材料符合相關(guān)標準的證明性資料,包括產(chǎn)品表面的涂層及制造過程中使用的焊接劑�、粘合劑、著色劑�、潤滑劑等。建議產(chǎn)品組成材料以列表的形式提供����,并與產(chǎn)品結(jié)構(gòu)圖示中標識的部件一一對應(yīng)。若產(chǎn)品組成材料為混合物��,還應(yīng)明確各組分��。對于采用分層/分段結(jié)構(gòu)設(shè)計的�����,逐層/逐段分別進行描述����。對于首次應(yīng)用于醫(yī)療器械的新材料,需提供該材料適合用于人體預(yù)期使用用途���、使用部位及安全性的相關(guān)研究資料�����。
1.4 型號規(guī)格明確產(chǎn)品型號規(guī)格的表述方式�����、劃分依據(jù)以及各型號規(guī)格間的異同點�,可采用對比表或帶有說明性文字的圖片、圖表對不同型號規(guī)格的結(jié)構(gòu)組成��、功能����、產(chǎn)品特征、技術(shù)參數(shù)等加以描述��。
2.包裝說明
說明與滅菌方法相適應(yīng)的無菌屏障系統(tǒng)信息(包括與產(chǎn)品直接接觸的其他包裝信息)����。建議提供產(chǎn)品包裝結(jié)構(gòu)示意圖和/或照片,包裝材料通用名稱/化學名稱�、商品名/牌號(如有),標明包裝尺寸�,并明確與產(chǎn)品一起銷售的附件的包裝情況。
3.適用范圍和禁忌證
明確申報產(chǎn)品的適用范圍�,可參考《免于臨床評價醫(yī)療器械目錄》的描述,并結(jié)合產(chǎn)品設(shè)計特點進行制定�。建議考慮不同使用部位對于涂層完整性及潤滑性可能產(chǎn)生的影響。明確目標用戶及其操作或使用該產(chǎn)品應(yīng)當具備的技能/知識/培訓;說明預(yù)期與申報產(chǎn)品配合使用的器械�����,如導(dǎo)絲等����。明確預(yù)期使用環(huán)境和適用人群的信息��。如適用��,說明申報產(chǎn)品不推薦或禁忌使用的疾病����、情況或特定的人群。
4.產(chǎn)品配合使用及兼容性
對于帶潤滑涂層的導(dǎo)管鞘����,建議在明確配合使用產(chǎn)品的尺寸信息時,考慮涂層磨損的因素��;明確血管介入手術(shù)過程中可能會對涂層的完整性造成影響的物質(zhì)(如酒精�、抗菌劑等)。
5.一次性使用血管內(nèi)導(dǎo)管鞘產(chǎn)品技術(shù)要求與檢驗方法
產(chǎn)品技術(shù)要求中的性能指標����、檢驗方法執(zhí)行YY0450.1《一次性使用無菌血管內(nèi)導(dǎo)管輔件 第1 部分導(dǎo)引器械》�,參考YY0285.1《血管內(nèi)導(dǎo)管 一次性使用無菌導(dǎo)管第1 部分通用要求》等相關(guān)標準�����,結(jié)合產(chǎn)品結(jié)構(gòu)特征���、臨床應(yīng)用來制定����,同時還需符合《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》的要求�。
一次性使用血管內(nèi)導(dǎo)管鞘產(chǎn)品建議的性能指標包括:外觀、末端頭端����、尺寸、座�����、耐腐蝕性�、射線可探測性、無泄漏�、導(dǎo)絲兼容性��、器械兼容性��、抗折彎�、抗扭強度(如適用)���、峰值拉力�����、涂層完整性及潤滑性(如適用)、水合性����、微粒污染、化學性能��、環(huán)氧乙烷殘留量(如適用)��、細菌內(nèi)毒素等���。
更多有關(guān)一次性使用血管內(nèi)導(dǎo)管鞘注冊咨詢��,歡迎您隨時方便與杭州證標客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)�,聯(lián)系人:葉工,電話:18058734169��,微信同�����。