隨著中國(guó)加入ICH組織,CRC(臨床協(xié)調(diào)員)在醫(yī)療器械臨床試驗(yàn)?質(zhì)量及合規(guī)方面���,扮演著越來(lái)越重要的角色�����。我們看到�,越來(lái)越多的研究中心�、申辦方要求CRC進(jìn)入醫(yī)療器械臨床試驗(yàn)研究項(xiàng)目����。我們一起來(lái)了解一下CRC在臨床試驗(yàn)中的職責(zé)���。
引言:隨著中國(guó)加入ICH組織,CRC(臨床協(xié)調(diào)員)在醫(yī)療器械臨床試驗(yàn)質(zhì)量及合規(guī)方面����,扮演著越來(lái)越重要的角色。我們看到����,越來(lái)越多的研究中心、申辦方要求CRC進(jìn)入醫(yī)療器械臨床試驗(yàn)研究項(xiàng)目�����。我們一起來(lái)了解一下CRC在臨床試驗(yàn)中的職責(zé)�����。
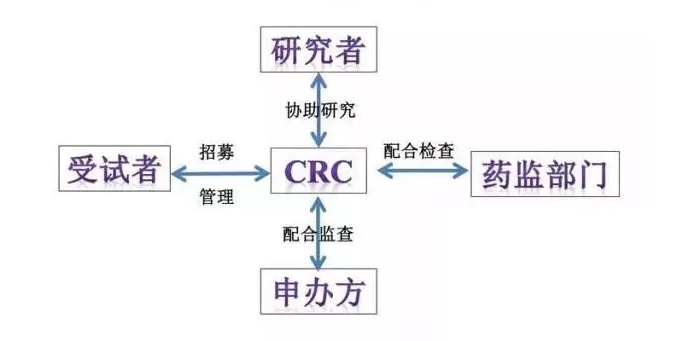
一���、CRC與醫(yī)療器械臨床試驗(yàn)相關(guān)方:
CRC既臨床協(xié)調(diào)員�,從名稱我們也可以猜到,在醫(yī)療器械臨床試驗(yàn)中的溝通協(xié)調(diào)是CRC的主要工作之一���。在醫(yī)療器械臨床試驗(yàn)中��,CRC需要與申辦方���、受試者、研究者����、藥監(jiān)部門、研究中心臨床研究機(jī)構(gòu)等相關(guān)方密切溝通��,做好協(xié)調(diào)工作�����。
二����、CRC在醫(yī)療器械臨床試驗(yàn)中的主要職責(zé):
CRC在醫(yī)療器械臨床試驗(yàn)中協(xié)助研究者進(jìn)行指定臨床試驗(yàn)項(xiàng)目中的非醫(yī)學(xué)判斷類工作,主要工作內(nèi)容包括:
(1)協(xié)助研究者開(kāi)展非醫(yī)學(xué)判斷相關(guān)的工作�,進(jìn)行受試者的篩選工作,具體包括:從病歷庫(kù)或門診病人中收集潛在受試者����;對(duì)現(xiàn)有病人進(jìn)行初步排除�����;檢查研究者的入排表格是否有遺漏或邏輯錯(cuò)誤。定期向甲方提交受試者篩選進(jìn)度相關(guān)記錄�。
(2)受試者隨訪:按照醫(yī)療器械臨床試驗(yàn)方案,協(xié)助研究者完成受試者隨訪工作��,包括安排受試者訪視�����、各項(xiàng)檢查���、獲取檢查結(jié)果并找研究者審閱簽字等�����。并協(xié)助研究者審閱受試者記錄是否完整等��。
(3)負(fù)責(zé)或協(xié)助入組受試者的管理(原始文檔管理�����,包括門診和住院病歷�����,研究專用病歷���,研究者文件的管理��、CRF填寫��、隨訪管理——提醒研究者醫(yī)囑并檢查執(zhí)行情況)�,每周五下班前提交本周工作匯總給乙方GCP辦公室����、研究者及甲方CRA。
(4)如遇受試者脫落或退組��,CRC需協(xié)助研究者處理及記錄相關(guān)信息���。提供受試者脫落或退組的相關(guān)信息郵件發(fā)送給CRA和甲方�。
(5)協(xié)助研究者上報(bào)SAE:在獲知SAE發(fā)生的24小時(shí)內(nèi)�����,CRC協(xié)助研究者填寫SAE表格后上報(bào)PI審核,確需上報(bào)����,則按相關(guān)程序向有關(guān)部門報(bào)告SAE。提醒研究者對(duì)不良事件的處理�����、記錄及跟蹤隨訪��。
(6)每周提交周報(bào)給GCP辦公室�����,接受GCP機(jī)構(gòu)管理����,有入組患者和篩選患者時(shí)或其它重要文件發(fā)生時(shí)需詳細(xì)匯報(bào)工作情況���。
(7)申辦方或管理部門的稽查和視察的配合和協(xié)調(diào)���。
(8)票據(jù)管理。
(9)多方溝通及記錄�,協(xié)調(diào)或協(xié)助研究者完成相關(guān)病例的答疑工作��。
(10)試驗(yàn)物資管理等事項(xiàng)���。