FDA發(fā)布醫(yī)療器械唯一標(biāo)識(shí) (UDI) 的形式和內(nèi)容指南文件
發(fā)布日期:2021-11-14 14:02瀏覽次數(shù):3254次
近年來,全球醫(yī)療器械主流市場監(jiān)管機(jī)構(gòu)�,無論是NMPA、歐盟����,還是FDA,都在致力于推動(dòng)���、推廣醫(yī)療器械唯一標(biāo)識(shí)UDI在醫(yī)療器械全生命周期中的應(yīng)用�����。近日��,F(xiàn)DA發(fā)布《醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng):醫(yī)療器械唯一標(biāo)識(shí)? (UDI) 的形式和內(nèi)容》指南文件,一起來了解一下��。
近年來,全球醫(yī)療器械主流市場監(jiān)管機(jī)構(gòu)����,無論是NMPA、歐盟���,還是FDA��,都在致力于推動(dòng)����、推廣醫(yī)療器械唯一標(biāo)識(shí)UDI在醫(yī)療器械全生命周期中的應(yīng)用��。近日�,F(xiàn)DA發(fā)布《醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng):醫(yī)療器械唯一標(biāo)識(shí) (UDI) 的形式和內(nèi)容》指南文件,一起來了解一下����。
2021年7月7日, FDA發(fā)布《醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng):醫(yī)療器械唯一標(biāo)識(shí) (UDI) 的形式和內(nèi)容》文件�。該文件不適用于通用產(chǎn)品代碼,旨在協(xié)助貼標(biāo)者和 FDA 認(rèn)證簽發(fā)機(jī)構(gòu)遵守醫(yī)療器械唯一標(biāo)識(shí) (Unique Device Identifier �,UDI ) 標(biāo)簽要求,包括闡明 FDA 對(duì) 21 CFR 801.40 下某些要求的解讀��。描述關(guān)于 UDI 形式和內(nèi)容要求,以及 FDA 的建議�,以確保根據(jù) UDI發(fā)布系統(tǒng)開發(fā)的 UDI ,符合醫(yī)療器械唯一標(biāo)識(shí)系統(tǒng)最終規(guī)則 78 FR 58786(2013 年 9 月 24 日)的目的?,F(xiàn)就有關(guān)內(nèi)容概述如下:
1.背景
UDI 規(guī)則要求每個(gè)醫(yī)療器械的標(biāo)簽和器械包裝均帶有 UDI,除非有例外情況或替代方案適用 (21 CFR 801.20)�����。如果器械預(yù)期使用超過一次�,并計(jì)劃在每次使用前再處理,則部分器械需要在器械本身貼附永久性標(biāo)記���,提供 UDI (21 CFR 801.45)��。根據(jù) UDI 規(guī)則����,每個(gè)貼標(biāo)者必須使用一個(gè)或多個(gè)經(jīng) FDA 認(rèn)證簽發(fā)機(jī)構(gòu)運(yùn)作的系統(tǒng)��,其指定 UDI 顯示在器械標(biāo)簽��、器械包裝上�����,如適用��,可在設(shè)備上直接標(biāo)記(21 CFR 801.20��、801.45 和 830.20)��。
UDI 必須在器械標(biāo)簽和器械包裝上以兩種形式呈現(xiàn):(1) 易讀純文本�����;(2) 自動(dòng)識(shí)別和數(shù)據(jù)采集 (automatic identification and data capture ��,AIDC) 技術(shù) (21 CFR 801.40(a))�����。當(dāng)器械必須帶有 UDI 作為直接標(biāo)記時(shí)�,UDI 可以通過易讀純文本或/和 AIDC 技術(shù)形式提供,或通過任何可按需提供器械 UDI 的替代技術(shù)提供 (21 CFR 801.45(c))����。
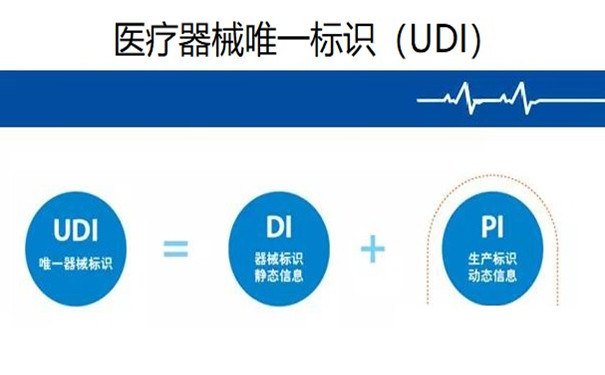
2.醫(yī)療器械唯一標(biāo)識(shí) (UDI)
“醫(yī)療器械唯一標(biāo)識(shí)”定義為“通過滿足 [21 CFR 830.20] 的要求,在分發(fā)和使用期間可以正確識(shí)別某種器械的一種標(biāo)識(shí)符” (21 CFR 801.3)�。UDI 由器械標(biāo)識(shí)符 (device identifier ,DI) 和生產(chǎn)標(biāo)識(shí)符 (production identifier ����,PI) 組成�����?!捌餍禈?biāo)識(shí)符”定義為 “UDI 的強(qiáng)制固定組成部分�����,用于識(shí)別器械的特定版本或型號(hào)以及器械的貼標(biāo)者” (21 CFR 801.3)��?!吧a(chǎn)標(biāo)識(shí)符”在 21 CFR 801.3 中的定義為 “UDI 的視條件可改變的部分,當(dāng)出現(xiàn)在器械標(biāo)簽上時(shí)�����,該部分用于識(shí)別下列一項(xiàng)或多項(xiàng)內(nèi)容:
(i) 制造器械的批號(hào)或批次�����;
(ii) 特定器械的序列號(hào)���;
(iii) 特定器械的到期日期�;
(iv) 特定器械的生產(chǎn)日期;
(v) 對(duì)于作為器械監(jiān)管的 HCT/P����,本章 21 CFR 1271.290(c) 要求的獨(dú)特識(shí)別碼。
根據(jù) 21 CFR 830.20�,UDI 必須通過 FDA 認(rèn)證簽發(fā)機(jī)構(gòu)運(yùn)作的系統(tǒng)簽發(fā)���,并符合以下 21 CFR 830.10 通過引用納入到 UDI 規(guī)則的國際標(biāo)準(zhǔn):
ISO/IEC 15459-2:信息技術(shù) - 唯一標(biāo)識(shí)——第 2 部分:注冊程序���;
ISO/IEC 15459-4:信息技術(shù) - 唯一標(biāo)識(shí)——第 4 部分:單個(gè)項(xiàng)目;
ISO/IEC 15459-6:信息技術(shù) - 唯一標(biāo)識(shí)——第 6 部分:產(chǎn)品分組的唯一標(biāo)識(shí)��。
此外�,UDI 只能使用 ISO/IEC 646 恒定字符集的字符和數(shù)字:信息技術(shù) - 用于信息交換的 ISO 7 位編碼字符集。每個(gè) FDA 認(rèn)證簽發(fā)機(jī)構(gòu)必須開發(fā)并運(yùn)作一個(gè)符合 21 CFR 第 801 部分 B 子部分下 UDI 標(biāo)簽要求的 UDI 分配系統(tǒng)�,使貼標(biāo)者能夠放心使用 FDA 認(rèn)證簽發(fā)機(jī)構(gòu)系統(tǒng)分配的符合這些要求的 UDI。
2.1 UDI 的形式
器械標(biāo)簽和器械包裝上的 UDI 必須以易讀純文本和 AIDC 技術(shù)形式呈現(xiàn) (21 CFR 801.40(a))�����。
此外�����,某些器械需要根據(jù) 21 CFR 801.45 直接標(biāo)記。對(duì)于這些器械����,可通過易讀純文本或/和 AIDC 技術(shù),或任何可按需提供器械 UDI 的替代技術(shù)直接在器械上標(biāo)記 UDI (21 CFR 801.45(c))��。
UDI(尤其通過 AIDC 技術(shù)提供時(shí))旨在快速����、準(zhǔn)確的實(shí)現(xiàn)數(shù)據(jù)采集、記錄和檢索��。易讀純文本形式使醫(yī)務(wù)人員�、患者、FDA 和 UDI 系統(tǒng)的其他用戶能夠在無技術(shù)協(xié)助的情況下閱讀 UDI 并將其輸入數(shù)據(jù)系統(tǒng)����,例如患者記錄或交給 FDA 的報(bào)告。因此��,如果無法使用 AIDC 形式���,則易讀純文本形式可用作采集 UDI 的附加機(jī)制��。
2.2 易讀純文本
“易讀純文本”指 UDI 數(shù)據(jù)字符的人類易讀解釋��,其形式必須包括 DI���;如適用����,還應(yīng)包括 PI����。UDI 的易讀純文本形式還需要包括任何數(shù)據(jù)分隔符�����。UDI 的易讀純文本形式可能顯示為單行或多行文本��,并應(yīng)顯示在 UDI 的 AIDC 技術(shù)形式下方或附近��。
2.3 AIDC
AIDC 在 21 CFR 801.3 中的定義為通過自動(dòng)化流程以可輸入電子患者記錄或其他計(jì)算機(jī)系統(tǒng)的形式傳輸器械 UDI 或 UDI DI 部分的任何技術(shù)���。UDI 的 AIDC 形式必須采用條形碼掃描儀或其他 AIDC 技術(shù)可讀取的格式 (21 CFR 801.3 和 801.40(a))���。貼標(biāo)者應(yīng)確保在分發(fā)和使用期間需要識(shí)別器械信息時(shí)���,能夠有效讀取 UDI 的 AIDC 形式。貼標(biāo)者應(yīng)參考其合作 FDA 認(rèn)證簽發(fā)機(jī)構(gòu)的指南��,以確定簽發(fā)機(jī)構(gòu)的 UDI 系統(tǒng)支持哪些形式的 AIDC���。FDA 建議將 UDI 的 AIDC 形式顯示在一個(gè)符段中���;但是,其可能會(huì)分成多個(gè)符段�����。貼標(biāo)者可以選擇在單個(gè)器械標(biāo)簽�、器械包裝或器械上使用多種類型的 AIDC 技術(shù)(如適用),以協(xié)助可能采用不同 UDI 采集技術(shù)方法的用戶�����。
如果貼標(biāo)者選擇一種 AIDC 條形碼形式��,則應(yīng)測試 UDI 的條形碼形式的印刷質(zhì)量��。FDA 建議參考以下標(biāo)準(zhǔn)和技術(shù)參考�����,了解有關(guān)確定印刷質(zhì)量的更多信息:
ISO/IEC 15416: 信息技術(shù)——自動(dòng)識(shí)別和數(shù)據(jù)采集技術(shù)——條形碼印刷質(zhì)量測試規(guī)范——線狀符號(hào);
ISO/IEC 15415: 信息技術(shù)——自動(dòng)識(shí)別和數(shù)據(jù)采集技術(shù)——條形碼符號(hào)印刷質(zhì)量測試規(guī)范——二維符號(hào)��;
ISO/IEC TR 29158: 信息技術(shù)——自動(dòng)識(shí)別和數(shù)據(jù)采集技術(shù)——直接部件標(biāo)記 (DPM) 質(zhì)量指南���。
如果用于傳達(dá) UDI 的 AIDC 技術(shù)形式在目視檢查器械標(biāo)簽或器械包裝時(shí)不明顯���,則器械標(biāo)簽或器械包裝必須披露是否使用了 AIDC 技術(shù)。FDA 建議��,如果使用符合 21 CFR 801.15(c) 的符號(hào)����,則貼標(biāo)者應(yīng)考慮使用國際公認(rèn)的符號(hào)���。
2.4 UDI 的內(nèi)容
UDI 載體可能包括有關(guān)器械的其他非 UDI 信息��。FDA 認(rèn)為這些額外的非 UDI 元素不屬于 UDI 的一部分���,其他非 UDI 元素的數(shù)據(jù)分隔符應(yīng)與 UDI 中的 DI 和 PI 數(shù)據(jù)分隔符區(qū)分。器械標(biāo)識(shí)符段和生產(chǎn)標(biāo)識(shí)符段不得包含非 UDI 元素或非 UDI 元素的數(shù)據(jù)分隔符��。UDI 規(guī)則不要求標(biāo)簽上包含 PI 的五個(gè)標(biāo)識(shí)符中的任何一個(gè)。但是�����,其他法規(guī)可能要求標(biāo)簽上包含 PI 的一個(gè)或多個(gè)標(biāo)識(shí)符�。在某些情況下,UDI 可能僅包含 DI�。I 類器械的 UDI 不需要包含 PI (21 CFR 801.30(d))。
2.5 數(shù)據(jù)分隔符
“數(shù)據(jù)分隔符”指定義的數(shù)據(jù)字符或數(shù)據(jù)字符集�����,用于識(shí)別 UDI 載體中表示的編碼數(shù)據(jù)串中的特定數(shù)據(jù)元素���。用于識(shí)別緊隨其后的信息���,并且根據(jù)不同 FDA 認(rèn)證簽發(fā)機(jī)構(gòu)建立的 UDI 系統(tǒng)而有所不同。
數(shù)據(jù)分隔符是 UDI 易理解度和實(shí)用度的關(guān)鍵��。數(shù)據(jù)分隔符指示并區(qū)分 UDI 載體中表示的數(shù)據(jù)串中的每個(gè)數(shù)據(jù)元素���,且納入數(shù)據(jù)分隔符對(duì)于 UDI 的易讀純文本和 AIDC 形式都很重要����。數(shù)據(jù)分隔符允許用戶以 UDI 的易讀純文本形式分析 DI 和 PI,并驗(yàn)證在 UDI 的 AIDC 形式中編碼的信息與 UDI 的易讀純文本形式相匹配����。
數(shù)據(jù)分隔符還能夠?qū)崿F(xiàn) UDI 在掃描后解析到電子系統(tǒng)中。數(shù)據(jù)分隔符允許將 UDI 與 UDI 載體中可能表示的任何非 UDI 元素區(qū)分并分別采集��。如果 UDI 載體中包含非 UDI 元素�,則應(yīng)納入這些非 UDI 元素的單獨(dú)數(shù)據(jù)分隔符。如果沒有適當(dāng)?shù)臄?shù)據(jù)分隔符來識(shí)別非 UDI 元素���,個(gè)人可能無法使用 UDI 的易讀純文本形式來識(shí)別器械�����,計(jì)算機(jī)系統(tǒng)可能無法通過自動(dòng)化流程準(zhǔn)確捕獲 AIDC 形式的 UDI�。
2.6 UDI 載體易讀純文本形式的數(shù)據(jù)順序
在易讀純文本形式中����,UDI 應(yīng)先于任何非 UDI 元素����。排序?yàn)槭紫戎付?DI,然后指定 PI(如有)�。如果 UDI 載體中有任何非 UDI 元素����,則非 UDI 元素應(yīng)位于作為 UDI 易讀純文本形式一部分的 PI 之后���。雖然 FDA 不禁止在 UDI 載體中納入數(shù)量����,但數(shù)量不被視為 UDI 的一部分����,且數(shù)量的數(shù)據(jù)分隔符應(yīng)與 UDI 中的 DI 和 PI 數(shù)據(jù)分隔符區(qū)分。
2.7 獨(dú)立軟件
獨(dú)立軟件的標(biāo)簽要求有所不同�,具體取決于其是否以包裝形式分發(fā) (21 CFR 801.50)。對(duì)于未以包裝形式分發(fā)的獨(dú)立軟件����,如果通過以下任一種或兩種形式提供 UDI,且版本號(hào)已在其 PI 中表示����,則符合 UDI 標(biāo)簽要求:
軟件啟動(dòng)時(shí)顯示的易讀純文本聲明;或通過菜單命令顯示的易讀純文本聲明 (21 CFR 801.50(a))��。
對(duì)于以包裝形式分發(fā)的獨(dú)立軟件,21 CFR 801.50(a) 不適用�����。獨(dú)立軟件必須提供 UDI�,作為軟件啟動(dòng)時(shí)或通過菜單命令顯示的易讀純文本聲明 (21 CFR 801.50(b))。器械標(biāo)簽�、器械包裝必須同時(shí)帶有易讀純文本和 AIDC 形式的 UDI (21 CFR 801.20(a) 和 801.40(a))。當(dāng)器械標(biāo)簽上包含制造器械的批號(hào)或批次時(shí)�,該批號(hào)或批次必須包含在 PI 中 (21 CFR 801.3 和 801.40(b))?��!败浖姹尽卑?21 CFR 801.3 的批號(hào)或批次定義中�。當(dāng)需要帶有 UDI 的獨(dú)立軟件的貼標(biāo)者在標(biāo)簽上納入軟件版本時(shí)��,必須通過 PI 顯示 (21 CFR 801.3���,801.50(b)��;另見 78 FR 58794)���。
以上是對(duì)FDA該文件主要內(nèi)容的簡介。對(duì)其進(jìn)行研究探討����,有助于借鑒國際先進(jìn)經(jīng)驗(yàn)和工作方式,提高我國醫(yī)療器械的監(jiān)管效率�����,從而更好地促進(jìn)我國醫(yī)療器械行業(yè)的發(fā)展��。