醫(yī)療器械臨床試驗(yàn)是指:獲得醫(yī)療器械臨床試驗(yàn)資格的醫(yī)療機(jī)構(gòu)(以下稱醫(yī)療機(jī)構(gòu))對(duì)申請(qǐng)注冊(cè)的醫(yī)療器械在正常使用條件下的安全性和有效性按照規(guī)定進(jìn)行試用或驗(yàn)證的過(guò)程����。醫(yī)療器械臨床試驗(yàn)的目的是評(píng)價(jià)受試產(chǎn)品是否具有預(yù)期的安全性和有效性 。
隨著新版GCP的發(fā)布��,醫(yī)療器械臨床試驗(yàn)流程也發(fā)生了變化��。新版GCP要求�����,醫(yī)療器械臨床試驗(yàn)按照國(guó)家有關(guān)部門對(duì)醫(yī)療器械臨床試驗(yàn)的有關(guān)規(guī)定�,選擇臨床醫(yī)療機(jī)構(gòu)進(jìn)行臨床試驗(yàn),并對(duì)臨床試驗(yàn)結(jié)果進(jìn)行跟蹤和分析�����,直至完成臨床試驗(yàn)報(bào)告�����。以下是醫(yī)療器械臨床試驗(yàn)流程的大致流程�����。
醫(yī)療器械臨床試驗(yàn)準(zhǔn)備:
一、臨床試驗(yàn)方案;
二�����、研究者手冊(cè)或等效文件;
三���、知情同意書樣張和其他任何提供給受試者的書面材料;
四�、招募受試者和向其宣傳的程序;
五�、主要研究者簡(jiǎn)歷和/或其他證明其資格的文件;
六、病例報(bào)告表樣張;
七�、給予受試者報(bào)酬或補(bǔ)償?shù)奈募?
八、倫理委員會(huì)履行職責(zé)所需要的其他文件;
九����、試驗(yàn)用醫(yī)療器械。
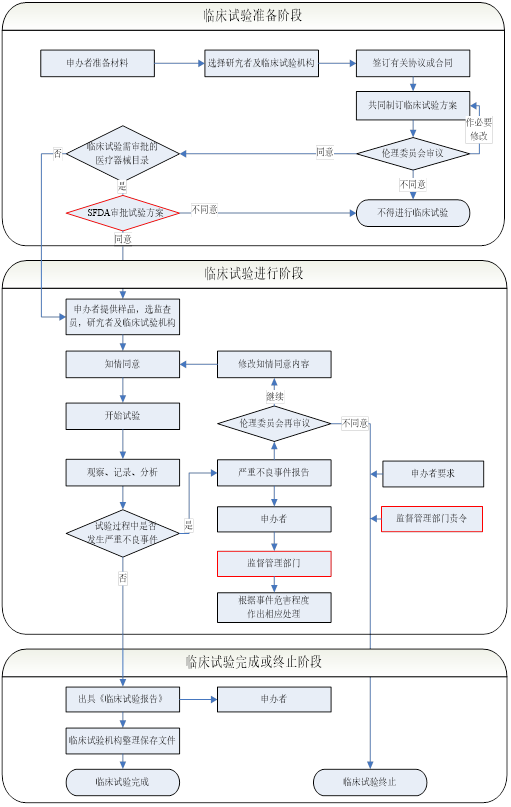
醫(yī)療器械臨床試驗(yàn)步驟:
步驟1:
申辦者根據(jù)自身的產(chǎn)品的特點(diǎn)����、預(yù)期用途、適應(yīng)癥���、適用范圍�、選擇臨床試驗(yàn)中心。至少需要確定兩家臨床上實(shí)驗(yàn)中心�,并與醫(yī)院負(fù)責(zé)承接臨床試驗(yàn)的負(fù)責(zé)人洽談是否可以承接臨床試驗(yàn)的項(xiàng)目。
步驟2:
如果可以承接的話���,就確定放在哪個(gè)科室進(jìn)行�����,其主要研究者的名字并收集齊研究者的主要履歷及簽名的樣張
步驟3:
對(duì)臨床方案和CRF表格的設(shè)計(jì),并召開(kāi)臨床方案的討論會(huì)議
步驟4:
準(zhǔn)備倫理委員會(huì)的材料��。一般包括: 一���、臨床試驗(yàn)方案; 二���、研究者手冊(cè)或等效文件; 三、知情同意書樣張和其他任何提供給受試者的書面材料; 四����、招募受試者和向其宣傳的程序; 五、主要研究者簡(jiǎn)歷和/或其他證明其資格的文件; 六���、病例報(bào)告表樣張; 七���、給予受試者報(bào)酬或補(bǔ)償?shù)奈募? 八�����、倫理委員會(huì)履行職責(zé)所需要的其他文件; 九�、試驗(yàn)用醫(yī)療器械�����。
步驟5:
如果倫理會(huì)通過(guò)的話��,需要與倫理會(huì)簽訂臨床協(xié)議的項(xiàng)目書�。
步驟6:
召開(kāi)臨床試驗(yàn)的啟動(dòng)會(huì)。
步驟7:
對(duì)臨床試驗(yàn)的過(guò)程進(jìn)行監(jiān)察和稽查��,并對(duì)臨床試驗(yàn)的過(guò)程中的記錄和醫(yī)療器械的發(fā)放進(jìn)行監(jiān)督和記錄����。
步驟8:
在臨床試驗(yàn)試驗(yàn)的后期對(duì)臨床的數(shù)據(jù)統(tǒng)計(jì)和分析,并對(duì)臨床報(bào)告的總結(jié)���。
步驟9:
得出臨床試驗(yàn)的結(jié)論:臨床試驗(yàn)的產(chǎn)品是安全���、有效的�?��;颊叱惺艿娘L(fēng)險(xiǎn)小于其受益���。