醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則(2022年修訂版) ,旨在指導(dǎo)注冊申請人規(guī)范醫(yī)療器械網(wǎng)絡(luò)安全生存周期過程和準備醫(yī)療器械網(wǎng)絡(luò)安全注冊申報資料�,同時規(guī)范醫(yī)療器械網(wǎng)絡(luò)安全的技術(shù)審評要求,為醫(yī)療器械軟件����、質(zhì)量管理軟件的體系核查提供參考����。
醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則(2022年修訂版)
本指導(dǎo)原則旨在指導(dǎo)注冊申請人規(guī)范醫(yī)療器械網(wǎng)絡(luò)安全生存周期過程和準備醫(yī)療器械網(wǎng)絡(luò)安全注冊申報資料����,同時規(guī)范醫(yī)療器械網(wǎng)絡(luò)安全的技術(shù)審評要求,為醫(yī)療器械軟件����、質(zhì)量管理軟件的體系核查提供參考。
本指導(dǎo)原則是對醫(yī)療器械網(wǎng)絡(luò)安全的一般要求����,注冊申請人需根據(jù)產(chǎn)品特性和風(fēng)險程度確定本指導(dǎo)原則具體內(nèi)容的適用性,若不適用詳述理由��。注冊申請人也可采用其他滿足法規(guī)要求的替代方法��,但需提供詳盡的研究資料�����。
本指導(dǎo)原則是在現(xiàn)行法規(guī)��、強制性標準體系以及當前科技能力���、認知水平下制定的��,隨著法規(guī)���、強制性標準體系的不斷完善以及科技能力、認知水平的不斷發(fā)展���,本指導(dǎo)原則相關(guān)內(nèi)容也將適時調(diào)整��。
本指導(dǎo)原則作為注冊申請人���、審評人員和檢查人員的指導(dǎo)性文件,不包括審評審批所涉及的行政事項�,亦不作為法規(guī)強制執(zhí)行,應(yīng)在符合法規(guī)要求的前提下使用本指導(dǎo)原則���。
本指導(dǎo)原則是數(shù)字醫(yī)療(Digital Health)指導(dǎo)原則體系的重要組成部分����,亦是醫(yī)療器械軟件指導(dǎo)原則的補充����,采用和遵循醫(yī)療器械軟件��、獨立軟件生產(chǎn)質(zhì)量現(xiàn)場檢查等相關(guān)指導(dǎo)原則的概念和要求���。
本指導(dǎo)原則是醫(yī)療器械網(wǎng)絡(luò)安全的通用指導(dǎo)原則,其他涉及網(wǎng)絡(luò)安全的醫(yī)療器械產(chǎn)品指導(dǎo)原則可在本指導(dǎo)原則基礎(chǔ)上進行有針對性的調(diào)整����、修改和完善。
一��、適用范圍
本指導(dǎo)原則適用于醫(yī)療器械網(wǎng)絡(luò)安全的注冊申報�,包括具備電子數(shù)據(jù)交換、遠程訪問與控制���、用戶訪問三種功能當中一種及以上功能的第二���、三類獨立軟件和含有軟件組件的醫(yī)療器械(包括體外診斷醫(yī)療器械);適用于自研軟件�����、現(xiàn)成軟件的注冊申報��。
其中,網(wǎng)絡(luò)包括無線��、有線網(wǎng)絡(luò)�����,電子數(shù)據(jù)交換包括基于網(wǎng)絡(luò)����、存儲媒介的單向�����、雙向數(shù)據(jù)傳輸�����,遠程訪問與控制包括基于網(wǎng)絡(luò)的實時���、非實時的訪問與控制�����,用戶(如醫(yī)務(wù)人員�����、患者����、維護人員等)訪問包括基于軟件用戶界面、電子接口的人機交互方式�����。
本指導(dǎo)原則也可用作醫(yī)療器械軟件��、質(zhì)量管理軟件的體系核查參考�����。
二���、主要概念
(一)醫(yī)療器械網(wǎng)絡(luò)安全
醫(yī)療器械網(wǎng)絡(luò)安全是指保護醫(yī)療器械產(chǎn)品自身和相關(guān)數(shù)據(jù)不受未授權(quán)活動影響的狀態(tài)����,其保密性(Confidentiality)�、完整性(Integrity)、可得性(Availability)[1]相關(guān)風(fēng)險在全生命周期均處于可接受水平[2]�。
其中���,保密性是指信息不被未授權(quán)實體(含產(chǎn)品、服務(wù)�����、個人�、組織)獲得或知悉的特性�,即醫(yī)療器械產(chǎn)品自身和相關(guān)數(shù)據(jù)僅可由授權(quán)用戶在授權(quán)時間以授權(quán)方式進行訪問和使用。完整性是指信息的創(chuàng)建�����、傳輸����、存儲、顯示未以非授權(quán)方式進行更改(含刪除���、添加)的特性�,即醫(yī)療器械相關(guān)數(shù)據(jù)是準確和完整的��,且未被篡改��。可得性是指信息可根據(jù)授權(quán)實體要求進行訪問和使用的特性����,即醫(yī)療器械產(chǎn)品自身和相關(guān)數(shù)據(jù)能以預(yù)期方式適時進行訪問和使用。
除保密性�����、完整性����、可得性三個基本特性外,醫(yī)療器械網(wǎng)絡(luò)安全還包括真實性(Authenticity)��、抗抵賴性(Non-Repudiation)��、可核查性(Accountability)�����、可靠性(Reliability)等特性����。其中,真實性是指實體符合其所聲稱的特性,抗抵賴性是指實體可證明所聲稱事件或活動的發(fā)生及其發(fā)起實體的特性�,可核查性是指實體的活動及結(jié)果可被追溯的特性,可靠性是指實體的活動及結(jié)果與預(yù)期保持一致的特性�。
保密性、完整性��、可得性等網(wǎng)絡(luò)安全特性通常是相互制約的關(guān)系���,在同等條件下�����,某一特性的能力提升可能會使得另一特性或多個特性的能力下降����,如可得性的提升可能會降低保密性和完整性���,因此需要基于產(chǎn)品特性進行平衡兼顧。注冊申請人需結(jié)合醫(yī)療器械的預(yù)期用途�、使用場景、核心功能進行綜合考量���,從而確定醫(yī)療器械網(wǎng)絡(luò)安全特性的具體要求����。
此外,盡管信息安全��、網(wǎng)絡(luò)安全�����、數(shù)據(jù)安全的定義和范圍各有側(cè)重����,既有聯(lián)系又有區(qū)別,不盡相同��,但本指導(dǎo)原則從醫(yī)療器械安全有效性評價角度出發(fā)對三者不做嚴格區(qū)分���,統(tǒng)一采用網(wǎng)絡(luò)安全進行表述��,即從網(wǎng)絡(luò)安全角度綜合考慮醫(yī)療器械的信息安全和數(shù)據(jù)安全�����。
(二)醫(yī)療器械相關(guān)數(shù)據(jù)
醫(yī)療器械相關(guān)數(shù)據(jù)可分為醫(yī)療數(shù)據(jù)和設(shè)備數(shù)據(jù)�。
醫(yī)療數(shù)據(jù)是指醫(yī)療器械所產(chǎn)生的���、使用的與醫(yī)療活動相關(guān)的數(shù)據(jù)(含日志)�,從個人信息保護角度又可分為敏感醫(yī)療數(shù)據(jù)、非敏感醫(yī)療數(shù)據(jù)���,其中敏感醫(yī)療數(shù)據(jù)是指含有個人信息的醫(yī)療數(shù)據(jù)[3]�����,反之即為非敏感醫(yī)療數(shù)據(jù)���。個人信息是指以電子或者其他方式記錄的能夠單獨或與其他信息結(jié)合識別自然人個人身份的各種信息,如自然人的姓名�����、出生日期��、身份證件號碼����、個人生物識別信息(含容貌信息)��、住址�����、電話號碼等。
設(shè)備數(shù)據(jù)是指記錄醫(yī)療器械運行狀況的數(shù)據(jù)(含日志)�,用于監(jiān)視、控制醫(yī)療器械運行或者醫(yī)療器械的維護與升級��,不得含有個人信息���。
注冊申請人需基于醫(yī)療器械相關(guān)數(shù)據(jù)的類型�、功能��、用途���,結(jié)合網(wǎng)絡(luò)安全特性考慮醫(yī)療器械網(wǎng)絡(luò)安全要求�。同時��,保證敏感醫(yī)療數(shù)據(jù)所含個人信息免于泄露��、濫用和篡改��,以及醫(yī)療數(shù)據(jù)和設(shè)備數(shù)據(jù)的有效隔離(如訪問權(quán)限控制等方法)��。
(三)醫(yī)療器械電子接口
本指導(dǎo)原則所述醫(yī)療器械電子接口(含硬件接口�、軟件接口)包括網(wǎng)絡(luò)接口���、電子數(shù)據(jù)交換接口,若無明示均指外部接口���,分體式醫(yī)療器械各獨立部分的內(nèi)部接口視為外部接口���,如服務(wù)器與客戶端、主機與從機的內(nèi)部接口����。
1.網(wǎng)絡(luò)接口
網(wǎng)絡(luò)接口是指基于網(wǎng)絡(luò)的電子接口。醫(yī)療器械可通過網(wǎng)絡(luò)接口(含轉(zhuǎn)接接口)進行電子數(shù)據(jù)交換或遠程訪問與控制���,此時需考慮網(wǎng)絡(luò)的技術(shù)特征要求����,包括但不限于網(wǎng)絡(luò)形式(有線����、無線)、網(wǎng)絡(luò)類型(如廣域網(wǎng)�、局域網(wǎng)�����、個域網(wǎng))、接口形式(如電口���、光口)��、數(shù)據(jù)接口(此時即數(shù)據(jù)協(xié)議�,含標準協(xié)議���、私有協(xié)議)�����、遠程訪問與控制方式(實時���、非實時)、性能指標(如端口�、傳輸速率、帶寬)等�����。
無線網(wǎng)絡(luò)包括Wi-Fi(IEEE 802.11)��、藍牙(IEEE 802.15)、射頻�����、紅外��、4G/5G等形式����,其中醫(yī)用無線專用設(shè)備(即未采用通用無線通信技術(shù)的醫(yī)療器械)應(yīng)符合中國無線電管理相關(guān)規(guī)定。標準協(xié)議即業(yè)內(nèi)公認標準所規(guī)范的數(shù)據(jù)傳輸協(xié)議�����,如DICOM�����、HL7等�����,需考慮其定制化功能的兼容性問題����;私有協(xié)議需考慮兼容性問題���。遠程訪問與控制亦包括操作系統(tǒng)軟件所提供的遠程會話或遠程桌面功能�����。
2.電子數(shù)據(jù)交換接口
電子數(shù)據(jù)交換接口是指基于非網(wǎng)絡(luò)的電子接口�����。醫(yī)療器械可通過非網(wǎng)絡(luò)接口的其他電子接口(如串口�����、并口��、USB口���、視頻接口�����、音頻接口���,含調(diào)試接口�����、轉(zhuǎn)接接口)或存儲媒介(如光盤���、移動硬盤、U盤)進行電子數(shù)據(jù)交換�����。此時需考慮其他電子接口或數(shù)據(jù)存儲的技術(shù)特征要求����。
其他電子接口可參照網(wǎng)絡(luò)接口明確其技術(shù)特征要求。數(shù)據(jù)存儲的技術(shù)特征要求包括但不限于存儲媒介形式�����、數(shù)據(jù)接口(此時即文件存儲格式�,含標準格式、私有格式)�����、數(shù)據(jù)壓縮方式(有損、無損)�����、性能指標(如傳輸速率��、容量)等�。標準格式即業(yè)內(nèi)公認標準所規(guī)范的文件存儲格式����,如JPEG、PNG等��,需考慮其文件格式完整性問題�����;私有格式需考慮兼容性問題�����。
注冊申請人需結(jié)合醫(yī)療器械電子接口的類型��、方式��、技術(shù)特征,基于網(wǎng)絡(luò)安全特性考慮其網(wǎng)絡(luò)安全的具體要求�����。
(四)醫(yī)療器械網(wǎng)絡(luò)安全能力
考慮到預(yù)期用途�����、使用場景的限制�����,醫(yī)療器械對于網(wǎng)絡(luò)安全威脅應(yīng)具備必要的識別�����、保護能力和適當?shù)奶綔y�����、響應(yīng)����、恢復(fù)能力。
本指導(dǎo)原則所述醫(yī)療器械網(wǎng)絡(luò)安全能力包括:
1.自動注銷(ALOF):產(chǎn)品在無人值守期間阻止非授權(quán)用戶訪問和使用的能力��。
2.審核(AUDT):產(chǎn)品提供用戶活動可被審核的能力。
3.授權(quán)(AUTH):產(chǎn)品確定用戶已獲授權(quán)的能力����。
4.節(jié)點鑒別(NAUT):產(chǎn)品鑒別網(wǎng)絡(luò)節(jié)點的能力。
5.人員鑒別(PAUT):產(chǎn)品鑒別授權(quán)用戶的能力�����。
6.連通性(CONN):產(chǎn)品保證連通網(wǎng)絡(luò)安全可控的能力��。
7.物理防護(PLOK):產(chǎn)品提供防止非授權(quán)用戶訪問和使用的物理防護措施的能力�����。
8.系統(tǒng)加固(SAHD):產(chǎn)品通過固化措施對網(wǎng)絡(luò)攻擊和惡意軟件的抵御能力��。
9.數(shù)據(jù)去標識化與匿名化(DIDT):產(chǎn)品直接去除����、匿名化數(shù)據(jù)所含個人信息的能力�����。
10.數(shù)據(jù)完整性與真實性(IGAU):產(chǎn)品確保數(shù)據(jù)未以非授權(quán)方式更改且來自創(chuàng)建者或提供者的能力�。
11.數(shù)據(jù)備份與災(zāi)難恢復(fù)(DTBK):產(chǎn)品的數(shù)據(jù)、硬件或軟件受到損壞或破壞后恢復(fù)的能力。
12.數(shù)據(jù)存儲保密性與完整性(STCF):產(chǎn)品確保未授權(quán)訪問不會損壞存儲媒介所存數(shù)據(jù)保密性和完整性的能力�。
13.數(shù)據(jù)傳輸保密性(TXCF):產(chǎn)品確保數(shù)據(jù)傳輸保密性的能力。
14.數(shù)據(jù)傳輸完整性(TXIG):產(chǎn)品確保數(shù)據(jù)傳輸完整性的能力���。
15.網(wǎng)絡(luò)安全補丁升級(CSUP):授權(quán)用戶安裝/升級產(chǎn)品網(wǎng)絡(luò)安全補丁的能力��。
16.現(xiàn)成軟件清單(SBOM):產(chǎn)品為用戶提供全部現(xiàn)成軟件清單的能力����。
17.現(xiàn)成軟件維護(RDMP):產(chǎn)品在全生命周期中對現(xiàn)成軟件提供網(wǎng)絡(luò)安全維護的能力�。
18.網(wǎng)絡(luò)安全使用指導(dǎo)(SGUD):產(chǎn)品為用戶提供網(wǎng)絡(luò)安全使用指導(dǎo)的能力。
19.網(wǎng)絡(luò)安全特征配置(CNFS):產(chǎn)品根據(jù)用戶需求配置網(wǎng)絡(luò)安全特征的能力�。
20.緊急訪問(EMRG):產(chǎn)品在預(yù)期緊急情況下允許用戶訪問和使用的能力。
21.遠程訪問與控制(RMOT):產(chǎn)品確保用戶遠程訪問與控制(含遠程維護與升級)的網(wǎng)絡(luò)安全的能力����。
22.惡意軟件探測與防護(MLDP):產(chǎn)品有效探測、阻止惡意軟件的能力���。
注冊申請人需根據(jù)醫(yī)療器械的產(chǎn)品特性分析上述網(wǎng)絡(luò)安全能力的適用性�����。若適用��,明確網(wǎng)絡(luò)安全能力的實現(xiàn)方式�����,可通過產(chǎn)品自身功能實現(xiàn)�����,亦可通過必備軟件��、外部軟件環(huán)境等外部措施實現(xiàn)�����。同時����,根據(jù)產(chǎn)品風(fēng)險水平明確網(wǎng)絡(luò)安全能力的強弱程度�����,例如:用戶訪問控制可采用用戶名和口令方式��,其中口令強度可采用不同強度設(shè)置或采用動態(tài)口令�,亦可采用生物識別技術(shù)����,通常情況下醫(yī)療器械的風(fēng)險水平越高則其用戶訪問控制要求越嚴格�。反之,若不適用詳述理由并予以記錄��。
值得注意的是�����,對于特定醫(yī)療器械產(chǎn)品�����,上述各項網(wǎng)絡(luò)安全能力可能不足以保證其網(wǎng)絡(luò)安全���,需結(jié)合產(chǎn)品具體情況補充其他網(wǎng)絡(luò)安全能力要求�����。
(五)網(wǎng)絡(luò)安全驗證與確認
網(wǎng)絡(luò)安全驗證與確認作為軟件驗證與確認的重要組成部分���,需在軟件驗證與確認的框架下,結(jié)合產(chǎn)品網(wǎng)絡(luò)安全特性開展相關(guān)質(zhì)控工作���,如源代碼安全審核�、威脅建模、漏洞掃描�、滲透測試、模糊測試等�。軟件驗證與確認相關(guān)要求詳見醫(yī)療器械軟件指導(dǎo)原則第二章。
注冊申請人需針對不同類型網(wǎng)絡(luò)威脅���,采用相應(yīng)技術(shù)手段來保證醫(yī)療器械的網(wǎng)絡(luò)安全��。例如:針對讀取攻擊��、操作攻擊����、欺騙攻擊�����、泛洪攻擊�����、重定向���、勒索攻擊等網(wǎng)絡(luò)威脅����,可采用用戶訪問控制��、端口與服務(wù)關(guān)閉��、加密�、數(shù)字簽名、標準協(xié)議�、校驗、防火墻����、入侵檢測、惡意代碼防護����、防護規(guī)則配置等方法與技術(shù)來保證產(chǎn)品的網(wǎng)絡(luò)安全。
(六)網(wǎng)絡(luò)安全可追溯性分析
網(wǎng)絡(luò)安全可追溯性分析作為網(wǎng)絡(luò)安全驗證與確認的重要活動之一���,是指追蹤網(wǎng)絡(luò)安全需求��、網(wǎng)絡(luò)安全設(shè)計����、源代碼、網(wǎng)絡(luò)安全測試����、網(wǎng)絡(luò)安全風(fēng)險管理之間的關(guān)系,分析已識別關(guān)系的正確性�����、一致性�����、完整性�����、準確性�����。
醫(yī)療器械網(wǎng)絡(luò)安全生存周期過程均應(yīng)開展網(wǎng)絡(luò)安全可追溯性分析活動���,具體要求可參照軟件可追溯性分析活動要求���,詳見醫(yī)療器械軟件指導(dǎo)原則第二章。
(七)網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)
醫(yī)療器械設(shè)計開發(fā)只能針對已知網(wǎng)絡(luò)安全漏洞采取相應(yīng)風(fēng)險控制措施����,上市后仍會面臨潛在未知的網(wǎng)絡(luò)安全漏洞引發(fā)的網(wǎng)絡(luò)安全事件的威脅,可能造成醫(yī)療器械無法訪問和使用���、醫(yī)療數(shù)據(jù)發(fā)生泄露或遭到篡改��,進而可能導(dǎo)致患者受到傷害或死亡以及隱私被侵犯�。同時����,醫(yī)療器械網(wǎng)絡(luò)安全事件具有影響因素多、涉及面廣���、擴散性強和突發(fā)性高等特點�,對于醫(yī)療器械上市后監(jiān)測要求相對較高�。因此,注冊申請人需基于相關(guān)標準和技術(shù)報告建立網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)機制�����,保證醫(yī)療器械的安全有效性并保護患者隱私。
應(yīng)制定網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)預(yù)案,涵蓋現(xiàn)成軟件要求����,明確計劃與準備�、探測與報告��、評估與決策����、應(yīng)急響應(yīng)實施、總結(jié)與改進等階段的任務(wù)和要求�。建立網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)團隊�����,根據(jù)工作職能形成管理、規(guī)劃����、監(jiān)測、響應(yīng)��、實施、分析等工作小組,必要時可邀請外部網(wǎng)絡(luò)安全專家成立專家小組���。
根據(jù)網(wǎng)絡(luò)安全事件的嚴重程度�、緊迫程度、廣泛程度等因素進行分類分級管理��,結(jié)合產(chǎn)品風(fēng)險級別,按照風(fēng)險管理要求開展應(yīng)急響應(yīng)措施的驗證工作并予以記錄�,在事件發(fā)生期間及時告知用戶應(yīng)對措施�。若適用����,按照醫(yī)療器械不良事件�����、召回相關(guān)法規(guī)要求處理;必要時���,向國家網(wǎng)絡(luò)安全主管部門報告��。
(八)醫(yī)療器械網(wǎng)絡(luò)安全更新
1.網(wǎng)絡(luò)安全更新
醫(yī)療器械網(wǎng)絡(luò)安全更新從內(nèi)容上可分為功能更新、補丁更新�,類似于增強類軟件更新���、糾正類軟件更新�����。根據(jù)其對醫(yī)療器械安全性和有效性的影響程度分為以下兩類:
(1)重大網(wǎng)絡(luò)安全更新:影響到醫(yī)療器械的安全性或有效性的網(wǎng)絡(luò)安全更新�����,即重大網(wǎng)絡(luò)安全功能更新�����,應(yīng)申請變更注冊。
(2)輕微網(wǎng)絡(luò)安全更新:不影響醫(yī)療器械的安全性與有效性的網(wǎng)絡(luò)安全更新,包括輕微網(wǎng)絡(luò)安全功能更新、網(wǎng)絡(luò)安全補丁更新�。輕微網(wǎng)絡(luò)安全更新通過質(zhì)量管理體系進行控制��,無需申請變更注冊,待下次變更注冊時提交相應(yīng)注冊申報資料���。
此外����,涉及召回的網(wǎng)絡(luò)安全更新����,無論功能更新還是補丁更新均屬于重大網(wǎng)絡(luò)安全更新���,按照醫(yī)療器械召回相關(guān)法規(guī)要求處理,不屬于本指導(dǎo)原則討論范疇����。
網(wǎng)絡(luò)安全更新同樣遵循風(fēng)險從高原則,即同時發(fā)生重大和輕微網(wǎng)絡(luò)安全更新按重大網(wǎng)絡(luò)安全更新處理���。同時���,軟件版本命名規(guī)則應(yīng)涵蓋網(wǎng)絡(luò)安全更新情況,區(qū)分重大和輕微網(wǎng)絡(luò)安全更新��。
2.重大網(wǎng)絡(luò)安全更新判定原則
網(wǎng)絡(luò)安全功能更新若影響到醫(yī)療器械的預(yù)期用途���、使用場景或核心功能原則上均屬于重大網(wǎng)絡(luò)安全更新,包括但不限于:產(chǎn)品預(yù)期運行的網(wǎng)絡(luò)環(huán)境發(fā)生改變���,如由封閉網(wǎng)絡(luò)環(huán)境變?yōu)殚_放網(wǎng)絡(luò)環(huán)境����、局域網(wǎng)變?yōu)閺V域網(wǎng)、有線網(wǎng)絡(luò)變?yōu)闊o線網(wǎng)絡(luò)�;產(chǎn)品預(yù)期使用的電子接口發(fā)生改變,如接口形式由網(wǎng)口變?yōu)閁SB口�、接口類型由少變多、接口功能由電子數(shù)據(jù)交換擴至遠程控制�;產(chǎn)品網(wǎng)絡(luò)安全能力發(fā)生實質(zhì)性改變,如自動注銷能力由操作系統(tǒng)自帶功能實現(xiàn)改為產(chǎn)品自身功能實現(xiàn)�、物理防護能力由有變無等。
除非影響到醫(yī)療器械的安全性或有效性��,以下網(wǎng)絡(luò)安全功能更新和網(wǎng)絡(luò)安全補丁更新通常視為輕微網(wǎng)絡(luò)安全更新:產(chǎn)品預(yù)期運行的網(wǎng)絡(luò)環(huán)境數(shù)據(jù)傳輸效率單純提高���,預(yù)期使用的電子接口原有功能單純優(yōu)化����、傳輸效率單純提高����,產(chǎn)品網(wǎng)絡(luò)安全能力發(fā)生非實質(zhì)性改變;醫(yī)療器械軟件��、必備軟件�����、外部軟件環(huán)境的網(wǎng)絡(luò)安全補丁更新。其中�����,必備軟件是指醫(yī)療器械軟件正常運行所必需的其他醫(yī)療器械軟件及醫(yī)用中間件�����,外部軟件環(huán)境是指醫(yī)療器械軟件正常運行所必需的系統(tǒng)軟件�����、通用應(yīng)用軟件��、通用中間件�、支持軟件,詳見醫(yī)療器械軟件指導(dǎo)原則�����。
三��、基本原則
(一)網(wǎng)絡(luò)安全定位
隨著網(wǎng)絡(luò)技術(shù)的發(fā)展��,越來越多的醫(yī)療器械具備網(wǎng)絡(luò)連接功能以進行電子數(shù)據(jù)交換或遠程訪問與控制�����,在提高醫(yī)療服務(wù)質(zhì)量與效率的同時也面臨著網(wǎng)絡(luò)攻擊的威脅����。醫(yī)療器械網(wǎng)絡(luò)安全出現(xiàn)問題不僅可能會侵犯患者隱私,而且可能會產(chǎn)生醫(yī)療器械非預(yù)期運行的風(fēng)險�����,導(dǎo)致患者或用戶受到傷害或死亡��。因此�����,醫(yī)療器械網(wǎng)絡(luò)安全是醫(yī)療器械安全性和有效性的重要組成部分之一���。
信息共享是保障醫(yī)療器械網(wǎng)絡(luò)安全的基本原則[4]����。及時獲得網(wǎng)絡(luò)安全漏洞��、事件等相關(guān)信息有助于識別、評估和應(yīng)對網(wǎng)絡(luò)安全風(fēng)險�����,保證醫(yī)療器械的安全有效性以及醫(yī)療活動的業(yè)務(wù)持續(xù)性���,因此��,鼓勵所有利益相關(guān)方在醫(yī)療器械全生命周期中主動積極共享網(wǎng)絡(luò)安全相關(guān)信息���。注冊申請人需充分利用網(wǎng)絡(luò)安全漏洞披露機制加強醫(yī)療器械網(wǎng)絡(luò)安全的設(shè)計開發(fā)和上市后監(jiān)測,如基于國家互聯(lián)網(wǎng)應(yīng)急中心(CNCERT/CC���,www.cert.org.cn)的國家信息安全漏洞共享平臺(CNVD�����,www.cnvd.org.cn)���,或其互認的國際信息安全漏洞庫所披露的漏洞信息,定期開展網(wǎng)絡(luò)安全風(fēng)險管理工作��。
醫(yī)療器械網(wǎng)絡(luò)安全需要注冊申請人�����、用戶、信息技術(shù)服務(wù)商等利益相關(guān)者的共同努力和通力合作方能得以保障�。雖然醫(yī)療器械在使用過程中常與非預(yù)期的設(shè)備或系統(tǒng)相連��,使得注冊申請人在保證醫(yī)療器械網(wǎng)絡(luò)安全方面存在諸多困難�����,但這不意味注冊申請人可以免除醫(yī)療器械網(wǎng)絡(luò)安全相關(guān)責(zé)任����。注冊申請人需保證醫(yī)療器械產(chǎn)品自身的網(wǎng)絡(luò)安全,明確預(yù)期的網(wǎng)絡(luò)環(huán)境和電子接口要求���,持續(xù)監(jiān)測���、評估、應(yīng)對�、分享網(wǎng)絡(luò)安全相關(guān)風(fēng)險,與其他利益相關(guān)者密切合作�,從而保證醫(yī)療器械的安全有效性。
醫(yī)療器械網(wǎng)絡(luò)安全也是網(wǎng)絡(luò)安全國家戰(zhàn)略的重要組成部分�����,因此醫(yī)療器械網(wǎng)絡(luò)安全亦應(yīng)符合網(wǎng)絡(luò)安全相關(guān)法律法規(guī)和部門規(guī)章的要求,如網(wǎng)絡(luò)安全法���、數(shù)據(jù)安全法�、個人信息保護法以及數(shù)據(jù)出境�����、重要數(shù)據(jù)識別等要求�。注冊申請人應(yīng)持續(xù)跟蹤相關(guān)法律法規(guī)和部門規(guī)章的制修訂情況,并滿足相應(yīng)適用要求�。
網(wǎng)絡(luò)安全新技術(shù)(如人工智能技術(shù))研究處于快速發(fā)展階段,醫(yī)療器械若采用網(wǎng)絡(luò)安全新技術(shù)來保證網(wǎng)絡(luò)安全�����,亦需基于新技術(shù)特性�����,并結(jié)合風(fēng)險管理開展相應(yīng)驗證與確認工作����。
(二)風(fēng)險導(dǎo)向
綜合考慮行業(yè)發(fā)展水平和風(fēng)險分級管理導(dǎo)向���,醫(yī)療器械網(wǎng)絡(luò)安全的風(fēng)險級別不同,其生命周期質(zhì)控要求和注冊申報資料要求亦不同�。
雖然網(wǎng)絡(luò)安全風(fēng)險與軟件風(fēng)險存在差異,但是網(wǎng)絡(luò)安全風(fēng)險作為軟件風(fēng)險的重要組成部分�,其風(fēng)險級別亦可參照軟件采用安全性級別進行表述[5]。在通常情形下�,醫(yī)療器械網(wǎng)絡(luò)安全的安全性級別與所屬醫(yī)療器械軟件的安全性級別相同��;在特殊情形下�����,網(wǎng)絡(luò)安全的安全性級別可低于軟件的安全性級別���,此時需詳述理由并按網(wǎng)絡(luò)安全的安全性級別提交相應(yīng)注冊申報資料����。
醫(yī)療器械網(wǎng)絡(luò)安全風(fēng)險同樣結(jié)合醫(yī)療器械的預(yù)期用途��、使用場景�����、核心功能進行綜合判定,特別是使用場景���。不同使用場景的網(wǎng)絡(luò)環(huán)境不同���,甚至存在巨大差異,對于醫(yī)療器械網(wǎng)絡(luò)安全的影響亦不同�����,如門診����、手術(shù)、住院����、急救、家庭�、轉(zhuǎn)運、公共場所等使用場景的網(wǎng)絡(luò)環(huán)境均有所不同��,因此對于適用于多個使用場景的醫(yī)療器械���,注冊申請人需保證醫(yī)療器械在每個使用場景的網(wǎng)絡(luò)安全����。
醫(yī)療器械網(wǎng)絡(luò)安全風(fēng)險管理活動通常包括:識別資產(chǎn)(Asset,對個人或組織有價值的物理和數(shù)字實體)��、威脅(Threat�,可能導(dǎo)致對個人或組織產(chǎn)生損害的非預(yù)期事件發(fā)生的潛在原因)和脆弱性(Vulnerability,可能會被威脅所利用的資產(chǎn)或風(fēng)險控制措施的弱點)��,評估威脅和脆弱性對于醫(yī)療器械和患者的影響以及被利用的可能性���,確定風(fēng)險水平并采取充分����、有效��、適宜的風(fēng)險控制措施�,基于風(fēng)險接受準則評估網(wǎng)絡(luò)安全綜合剩余風(fēng)險���,保證網(wǎng)絡(luò)安全綜合剩余風(fēng)險均處于可接受水平�����。
注冊申請人可結(jié)合醫(yī)療器械風(fēng)險管理和網(wǎng)絡(luò)安全風(fēng)險管理相關(guān)標準和技術(shù)報告的要求����,開展醫(yī)療器械網(wǎng)絡(luò)安全風(fēng)險管理工作。值得注意的是����,醫(yī)療器械風(fēng)險管理與網(wǎng)絡(luò)安全風(fēng)險管理在傳統(tǒng)上存在一定差異,注冊申請人若無法對二者進行有效整合����,則需分別獨立開展相應(yīng)風(fēng)險管理活動并予以記錄,同時考慮不同類型風(fēng)險控制措施的相互影響問題�。
(三)全生命周期質(zhì)控
與醫(yī)療器械軟件類似,注冊申請人應(yīng)在醫(yī)療器械全生命周期中持續(xù)關(guān)注網(wǎng)絡(luò)安全問題����,包括上市前、上市后等階段��。
醫(yī)療器械上市前結(jié)合質(zhì)量管理體系要求和醫(yī)療器械產(chǎn)品特性開展網(wǎng)絡(luò)安全質(zhì)控工作����,保證醫(yī)療器械的安全有效性;上市后根據(jù)網(wǎng)絡(luò)安全更新情況開展更新請求評估�、驗證與確認�、風(fēng)險管理���、用戶告知等活動�,持續(xù)保證醫(yī)療器械的安全有效性���。同時�����,建立網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)過程�,定期開展醫(yī)療器械網(wǎng)絡(luò)安全漏洞風(fēng)險評估工作�����,根據(jù)網(wǎng)絡(luò)安全漏洞披露相關(guān)要求�,及時將必要的網(wǎng)絡(luò)安全相關(guān)信息以及應(yīng)對措施告知用戶�。此外,可采用信息安全領(lǐng)域的良好工程實踐[6]來完善醫(yī)療器械網(wǎng)絡(luò)安全質(zhì)控工作���,以保證醫(yī)療器械的安全有效性�。
四�、醫(yī)療器械網(wǎng)絡(luò)安全生存周期過程
考慮到行業(yè)實際情況��,本指導(dǎo)原則不要求注冊申請人單獨建立醫(yī)療器械網(wǎng)絡(luò)安全生存周期(又稱生命周期)過程�,而是將其作為醫(yī)療器械軟件生存周期過程的重要組成部分予以整體考慮�����,待時機成熟時予以考量���。
注冊申請人需在醫(yī)療器械軟件生存周期過程考慮醫(yī)療器械網(wǎng)絡(luò)安全的質(zhì)控要求��,并可基于醫(yī)療器械網(wǎng)絡(luò)安全能力建設(shè)要求予以實施��,具體要求詳見醫(yī)療器械軟件指導(dǎo)原則第六章以及獨立軟件生產(chǎn)質(zhì)量管理規(guī)范及其現(xiàn)場檢查指導(dǎo)原則�����。
同時�����,注冊申請人可參考信息安全領(lǐng)域相關(guān)標準和技術(shù)報告��,完善醫(yī)療器械網(wǎng)絡(luò)安全生存周期過程的質(zhì)控要求���,本指導(dǎo)原則不再贅述����。
五���、技術(shù)考量
(一)現(xiàn)成軟件
現(xiàn)成軟件同樣存在網(wǎng)絡(luò)安全問題�����,注冊申請人應(yīng)根據(jù)質(zhì)量管理體系要求建立現(xiàn)成軟件網(wǎng)絡(luò)安全更新過程��,結(jié)合風(fēng)險管理要求�,及時將必要的現(xiàn)成軟件網(wǎng)絡(luò)安全信息及應(yīng)對措施告知用戶�。
同時,根據(jù)現(xiàn)成軟件與醫(yī)療器械軟件的關(guān)系類型開展相應(yīng)網(wǎng)絡(luò)安全質(zhì)控工作�����。對于現(xiàn)成軟件組件(即作為醫(yī)療器械軟件組成部分的現(xiàn)成軟件)���,重點關(guān)注其網(wǎng)絡(luò)安全問題對醫(yī)療器械使用效果的影響���,網(wǎng)絡(luò)安全的安全性級別判定亦需將其納入考量����。對于外部軟件環(huán)境(即作為醫(yī)療器械軟件運行環(huán)境組成部分的現(xiàn)成軟件)��,重點關(guān)注其網(wǎng)絡(luò)安全補丁對醫(yī)療器械安全有效性的影響���,網(wǎng)絡(luò)安全的安全性級別判定通常無需將其納入考量;需要說明的是��,網(wǎng)絡(luò)安全補丁對于醫(yī)療器械而言屬于設(shè)計變更��,需對醫(yī)療器械進行驗證����、確認。
(二)醫(yī)療數(shù)據(jù)出境
根據(jù)《中華人民共和國網(wǎng)絡(luò)安全法》《中華人民共和國數(shù)據(jù)安全法》《中華人民共和國個人信息保護法》《中華人民共和國人類遺傳資源管理條例》等法律法規(guī)相關(guān)規(guī)定�����,在中國境內(nèi)收集和產(chǎn)生的重要數(shù)據(jù)�����、個人信息和人類遺傳資源信息原則上應(yīng)在中國境內(nèi)存儲����,因業(yè)務(wù)需要確需向境外提供的���,應(yīng)按照國家網(wǎng)信部門會同國務(wù)院有關(guān)部門制定的辦法進行安全評估。
《國家健康醫(yī)療大數(shù)據(jù)標準��、安全和服務(wù)管理辦法(試行)》明確:健康醫(yī)療大數(shù)據(jù)應(yīng)存儲在境內(nèi)安全可信的服務(wù)器上����,因業(yè)務(wù)需要確需向境外提供的,應(yīng)按照相關(guān)法律法規(guī)及有關(guān)要求進行安全評估審核��。
醫(yī)療數(shù)據(jù)通常屬于重要數(shù)據(jù)[7]���,特別是敏感醫(yī)療數(shù)據(jù)含有個人信息�,因此醫(yī)療數(shù)據(jù)出境應(yīng)符合重要數(shù)據(jù)�����、個人信息����、人類遺傳資源信息出境安全評估相關(guān)規(guī)定。
(三)遠程維護與升級
遠程維護與升級雖為非醫(yī)療器械功能�����,但會影響醫(yī)療器械的安全有效性���,故亦需納入考量��。
具有遠程維護與升級功能的醫(yī)療器械可訪問和使用設(shè)備數(shù)據(jù)��,本身雖不涉及醫(yī)療數(shù)據(jù)�����,但若未能實現(xiàn)設(shè)備數(shù)據(jù)和醫(yī)療數(shù)據(jù)的有效隔離����,則存在醫(yī)療數(shù)據(jù)未授權(quán)訪問和使用以及被篡改的可能性��。遠程維護與升級所用電子接口也面臨網(wǎng)絡(luò)攻擊的威脅���,可能會影響醫(yī)療器械正常運行����,導(dǎo)致患者受到傷害或死亡以及隱私被侵犯��。醫(yī)療器械在遠程維護與升級過程中若無人值守,則可能存在醫(yī)療器械非授權(quán)訪問和使用的風(fēng)險�����。家用醫(yī)療器械的遠程維護與升級需考慮其對產(chǎn)品正常使用的影響及其風(fēng)險�。
因此,注冊申請人需明確遠程維護與升級的實現(xiàn)方法��、所用電子接口情況���、設(shè)備數(shù)據(jù)所含內(nèi)容��、設(shè)備數(shù)據(jù)與醫(yī)療數(shù)據(jù)的隔離方法����、網(wǎng)絡(luò)安全保證措施等技術(shù)特征�,并提供相應(yīng)研究資料和風(fēng)險管理資料。
此外���,境外遠程維護與升級若可訪問醫(yī)療數(shù)據(jù)���,亦應(yīng)符合醫(yī)療數(shù)據(jù)出境要求。
(四)遺留設(shè)備[8]
本指導(dǎo)原則所述遺留設(shè)備是指不能通過補丁更新���、補償控制等合理風(fēng)險控制措施抵御當前網(wǎng)絡(luò)安全威脅的醫(yī)療器械��。遺留設(shè)備可能無法應(yīng)對當前網(wǎng)絡(luò)安全威脅�����,導(dǎo)致產(chǎn)品綜合剩余風(fēng)險無法降至可接受水平����,降低醫(yī)療器械的安全有效性���。
醫(yī)療器械實際使用情況極為復(fù)雜����,使得遺留設(shè)備的判定較為困難�����。通常情況下可結(jié)合醫(yī)療器械的停售(EOL)����、停止售后服務(wù)(EOS)兩個時間點判定其是否屬于遺留設(shè)備:在售(以注冊證時效為準)的醫(yī)療器械均非遺留設(shè)備;停售但未停止售后服務(wù)的醫(yī)療器械��,若無法通過合理風(fēng)險控制措施抵御當前網(wǎng)絡(luò)安全威脅則為遺留設(shè)備,反之不屬于遺留設(shè)備����;停止售后服務(wù)的醫(yī)療器械均為遺留設(shè)備。
對于遺留設(shè)備���,注冊人應(yīng)按照質(zhì)量管理體系要求開展相應(yīng)質(zhì)控工作��,以保證產(chǎn)品網(wǎng)絡(luò)安全��,詳見獨立軟件生產(chǎn)質(zhì)量管理規(guī)范及其現(xiàn)場檢查指導(dǎo)原則��。
對于注冊證失效但尚未停止售后服務(wù)�����、注冊證有效但已停售的醫(yī)療器械����,注冊人應(yīng)根據(jù)質(zhì)量管理體系要求向現(xiàn)有用戶提供必要的網(wǎng)絡(luò)安全相關(guān)信息以及應(yīng)對措施����,以保證醫(yī)療器械的網(wǎng)絡(luò)安全。若無法保證醫(yī)療器械的網(wǎng)絡(luò)安全�,按遺留設(shè)備處理�����。
對于注冊證有效且在售的醫(yī)療器械���,若無法通過合理風(fēng)險控制措施抵御當前網(wǎng)絡(luò)安全威脅,則注冊人應(yīng)根據(jù)質(zhì)量管理體系要求制定相應(yīng)風(fēng)險控制措施����,并申請變更注冊�����。
六���、醫(yī)療器械網(wǎng)絡(luò)安全研究資料
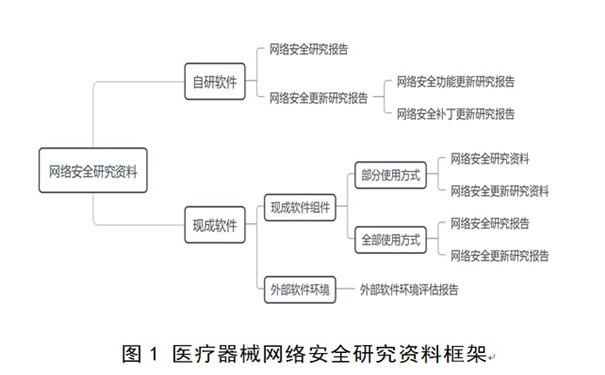
(一)自研軟件網(wǎng)絡(luò)安全研究報告
自研軟件網(wǎng)絡(luò)安全研究報告適用于自研軟件的初次發(fā)布和再次發(fā)布��,內(nèi)容框架詳見表1���,包括基本信息、實現(xiàn)過程���、漏洞評估���、結(jié)論���,詳盡程度取決于軟件安全性級別,不適用內(nèi)容詳述理由���。
1.基本信息
(1)軟件信息
明確申報醫(yī)療器械軟件的名稱�����、型號規(guī)格�、發(fā)布版本以及軟件安全性級別����。
若網(wǎng)絡(luò)安全的安全性級別低于軟件的安全性級別,詳述理由并按網(wǎng)絡(luò)安全的安全性級別提交相應(yīng)注冊申報資料���。
(2)數(shù)據(jù)架構(gòu)
提供申報醫(yī)療器械在每個使用場景(含遠程維護與升級�,下同)下的網(wǎng)絡(luò)環(huán)境和數(shù)據(jù)流圖��,并依據(jù)圖示描述醫(yī)療器械相關(guān)數(shù)據(jù)和電子接口的基本情況�����。
數(shù)據(jù)情況明確醫(yī)療器械相關(guān)數(shù)據(jù)的類型(敏感醫(yī)療數(shù)據(jù)、非敏感醫(yī)療數(shù)據(jù)�����、設(shè)備數(shù)據(jù))��,并依據(jù)數(shù)據(jù)類型明確每類數(shù)據(jù)的具體內(nèi)容(如個人信息����、醫(yī)療活動信息、設(shè)備運行信息)�����、功能(如單向�����、雙向電子數(shù)據(jù)交換���,實時、非實時遠程訪問與控制)���、用途(如醫(yī)療活動�����、設(shè)備維護)等���。
電子接口情況逐項說明每個網(wǎng)絡(luò)接口��、電子數(shù)據(jù)交換接口的預(yù)期用戶���、使用場景、預(yù)期用途����、數(shù)據(jù)類型、技術(shù)特征��、使用限制�,其中技術(shù)特征要求詳見第二章。
(3)網(wǎng)絡(luò)安全能力
基于第二章所述各項網(wǎng)絡(luò)安全能力����,逐項分析申報醫(yī)療器械對于該項網(wǎng)絡(luò)安全能力的適用性,詳述適用網(wǎng)絡(luò)安全能力的實現(xiàn)方法以及不適用理由����。若適用��,提供其他網(wǎng)絡(luò)安全能力的適用情況說明���。
(4)網(wǎng)絡(luò)安全補丁
提供申報醫(yī)療器械(含必備軟件、外部軟件環(huán)境)的網(wǎng)絡(luò)安全補丁列表���,明確網(wǎng)絡(luò)安全補丁的名稱�����、完整版本����、發(fā)布日期���?��?闪砀轿募?��。
(5)安全軟件
描述申報醫(yī)療器械兼容或所用的安全軟件(如殺毒軟件�����、防火墻等)的名稱��、型號規(guī)格����、完整版本、供應(yīng)商��、運行環(huán)境���、防護規(guī)則配置要求���。
2.實現(xiàn)過程
(1)風(fēng)險管理
提供申報醫(yī)療器械網(wǎng)絡(luò)安全的風(fēng)險分析報告、風(fēng)險管理報告�,另附網(wǎng)絡(luò)安全開發(fā)所形成的原始文件。亦可提供醫(yī)療器械軟件的風(fēng)險管理文檔�,但需注明網(wǎng)絡(luò)安全情況。
(2)需求規(guī)范
提供申報醫(yī)療器械的網(wǎng)絡(luò)安全需求規(guī)范文檔�,另附網(wǎng)絡(luò)安全開發(fā)所形成的原始文件。亦可提供醫(yī)療器械軟件的需求規(guī)范文檔����,但需注明網(wǎng)絡(luò)安全情況。
(3)驗證與確認
提供申報醫(yī)療器械的網(wǎng)絡(luò)安全測試計劃和報告,另附網(wǎng)絡(luò)安全開發(fā)所形成的原始文件��。亦可提供醫(yī)療器械軟件的系統(tǒng)測試計劃和報告��,但需注明網(wǎng)絡(luò)安全情況���。
對于安全軟件��,提供兼容性測試報告����。對于標準傳輸協(xié)議或存儲格式�,若其滿足醫(yī)療器械網(wǎng)絡(luò)安全需求出具真實性聲明即可,反之提供相應(yīng)證明材料�����;對于私有傳輸協(xié)議或存儲格式����,提供完整性測試總結(jié)報告。對于實時遠程訪問與控制功能��,提供完整性和可得性等網(wǎng)絡(luò)安全特性的測試報告�。對于醫(yī)用無線專用設(shè)備,提供符合無線電管理相關(guān)規(guī)定的證明材料���。
(4)可追溯性分析
提供申報醫(yī)療器械的網(wǎng)絡(luò)安全可追溯性分析報告���,匯總列明網(wǎng)絡(luò)安全需求規(guī)范文檔、網(wǎng)絡(luò)安全設(shè)計規(guī)范文檔���、源代碼(明確軟件單元名稱即可)�、網(wǎng)絡(luò)安全測試報告�����、網(wǎng)絡(luò)安全風(fēng)險分析報告之間的對應(yīng)關(guān)系�。亦可提供醫(yī)療器械軟件的可追溯性報告,但需注明網(wǎng)絡(luò)安全情況�。
(5)維護計劃
輕微級別:提供申報醫(yī)療器械網(wǎng)絡(luò)安全更新的流程圖,并依據(jù)圖示描述相關(guān)活動�。
中等、嚴重級別:在輕微級別的基礎(chǔ)上�����,提供網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)的流程圖���,并依據(jù)圖示描述相關(guān)活動�����;或者提供網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)預(yù)案文檔���。
若適用���,全部級別均需提供遠程維護與升級的流程圖,并依據(jù)圖示描述相關(guān)活動�。
3.漏洞評估
輕微級別:按照現(xiàn)行有效的通用漏洞評分系統(tǒng)(CVSS)所定義的漏洞等級,明確申報醫(yī)療器械(含必備軟件�����、外部軟件環(huán)境�����,下同)已知漏洞總數(shù)和已知剩余漏洞數(shù)����。
中等級別:提供網(wǎng)絡(luò)安全漏洞自評報告,明確漏洞掃描所用軟件工具���、漏洞庫(基于國家信息安全漏洞庫或互認的國際信息安全漏洞庫)的基本信息(如名稱�����、完整版本�、發(fā)布日期�、供應(yīng)商等),按照CVSS漏洞等級明確申報醫(yī)療器械已知漏洞總數(shù)和已知剩余漏洞數(shù)���,列明已知剩余漏洞的內(nèi)容��、對產(chǎn)品的影響及綜合剩余風(fēng)險�����,確保產(chǎn)品綜合剩余風(fēng)險均可接受�。亦可補充網(wǎng)絡(luò)安全評估機構(gòu)出具的網(wǎng)絡(luò)安全漏洞評估報告���。
嚴重級別:提供網(wǎng)絡(luò)安全漏洞自評報告���、網(wǎng)絡(luò)安全評估機構(gòu)出具的網(wǎng)絡(luò)安全漏洞評估報告,明確已知剩余漏洞的維護方案�����,確保產(chǎn)品綜合剩余風(fēng)險均可接受。
4.結(jié)論
概述申報醫(yī)療器械的網(wǎng)絡(luò)安全實現(xiàn)過程的規(guī)范性和網(wǎng)絡(luò)安全漏洞評估結(jié)果�,判定申報醫(yī)療器械的網(wǎng)絡(luò)安全是否滿足要求,受益是否大于風(fēng)險�����。
表1 自研軟件網(wǎng)絡(luò)安全研究報告框架
報告條款 | 軟件安全性級別 |
輕微 | 中等 | 嚴重 |
基本信息 | 軟件信息 | 明確軟件的基本情況和安全性級別 |
數(shù)據(jù)架構(gòu) | 提供每個使用場景的網(wǎng)絡(luò)環(huán)境和數(shù)據(jù)流圖��,描述醫(yī)療器械相關(guān)數(shù)據(jù)和電子接口的基本情況 |
網(wǎng)絡(luò)安全能力 | 明確網(wǎng)絡(luò)安全能力情況 |
網(wǎng)絡(luò)安全補丁 | 列明網(wǎng)絡(luò)安全補丁的基本情況 |
安全軟件 | 明確安全軟件的基本情況 |
實現(xiàn)過程 | 風(fēng)險管理 | 提供網(wǎng)絡(luò)安全的風(fēng)險分析報告�、風(fēng)險管理報告 |
需求規(guī)范 | 提供網(wǎng)絡(luò)安全需求規(guī)范文檔 |
驗證與確認 | 提供網(wǎng)絡(luò)安全的測試計劃和報告 |
可追溯性分析 | 提供網(wǎng)絡(luò)安全可追溯性分析報告 |
維護計劃 | 提供網(wǎng)絡(luò)安全更新、遠程維護與升級的流程圖及活動描述 | 提供網(wǎng)絡(luò)安全更新�、網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)、遠程維護與升級的流程圖及活動描述 |
漏洞評估 | 按照漏洞等級明確已知漏洞總數(shù)和剩余漏洞數(shù) | 提供網(wǎng)絡(luò)安全漏洞自評報告����,按照漏洞等級明確已知漏洞總數(shù)、已知剩余漏洞情況 | 提供網(wǎng)絡(luò)安全漏洞自評報告�、網(wǎng)絡(luò)安全評估機構(gòu)出具的網(wǎng)絡(luò)安全漏洞評估報告,明確已知剩余漏洞的維護方案 |
結(jié)論 | 概述網(wǎng)絡(luò)安全實現(xiàn)過程的規(guī)范性和網(wǎng)絡(luò)安全漏洞評估結(jié)果�����,判定網(wǎng)絡(luò)安全是否滿足要求 |
(二)自研軟件網(wǎng)絡(luò)安全更新研究報告
自研軟件網(wǎng)絡(luò)安全更新研究報告適用于自研軟件的再次發(fā)布����,包括網(wǎng)絡(luò)安全功能更新�����、網(wǎng)絡(luò)安全補丁更新等研究報告����。
網(wǎng)絡(luò)安全功能更新研究報告適用于自研軟件發(fā)生重大���、輕微網(wǎng)絡(luò)安全功能更新,或合并網(wǎng)絡(luò)安全補丁更新的情形����,內(nèi)容框架詳見表2,不再贅述��。
網(wǎng)絡(luò)安全補丁更新研究報告適用于自研軟件(含必備軟件�、外部軟件環(huán)境)僅發(fā)生網(wǎng)絡(luò)安全補丁更新的情形。其內(nèi)容包括軟件信息��、網(wǎng)絡(luò)安全補丁�、風(fēng)險管理、驗證與確認����、可追溯性分析���、維護計劃、漏洞評估�����、結(jié)論�����,具體要求詳見表2相應(yīng)說明���。
表2 自研軟件網(wǎng)絡(luò)安全功能更新研究報告框架
報告條款 | 軟件安全性級別 |
輕微 | 中等 | 嚴重 |
基本信息 | 軟件信息 | 明確本次申報軟件情況���,詳述變化 |
數(shù)據(jù)架構(gòu) | 明確本次申報軟件情況,詳述變化 |
網(wǎng)絡(luò)安全能力 | 明確本次申報軟件情況��,詳述變化 |
網(wǎng)絡(luò)安全補丁 | 列明網(wǎng)絡(luò)安全更新部分的補丁情況 |
安全軟件 | 明確本次申報軟件情況�����,詳述變化 |
實現(xiàn)過程 | 風(fēng)險管理 | 提供網(wǎng)絡(luò)安全更新部分的風(fēng)險分析報告、風(fēng)險管理報告 |
需求規(guī)范 | 提供網(wǎng)絡(luò)安全更新部分需求規(guī)范文檔 |
驗證與確認 | 提供網(wǎng)絡(luò)安全更新部分的測試計劃和報告 |
可追溯性分析 | 提供網(wǎng)絡(luò)安全更新部分的可追溯性分析報告 |
維護計劃 | 提供用戶告知計劃 | 提供用戶告知計劃���、網(wǎng)絡(luò)安全事件應(yīng)急響應(yīng)總結(jié)報告 |
漏洞評估 | 明確本次申報軟件已知漏洞總數(shù)和剩余漏洞數(shù) | 提供本次申報軟件的網(wǎng)絡(luò)安全自評報告���,按照漏洞等級明確已知漏洞總數(shù)、已知剩余漏洞情況 | 提供本次申報軟件的網(wǎng)絡(luò)安全自評報告����、網(wǎng)絡(luò)安全評估機構(gòu)出具的網(wǎng)絡(luò)安全漏洞評估報告,明確已知剩余漏洞的維護方案 |
結(jié)論 | 概述網(wǎng)絡(luò)安全更新實現(xiàn)過程的規(guī)范性和網(wǎng)絡(luò)安全漏洞評估結(jié)果��,判定網(wǎng)絡(luò)安全更新是否滿足要求 |
考慮到網(wǎng)絡(luò)安全更新具有累積效應(yīng)��,網(wǎng)絡(luò)安全更新研究報告需涵蓋醫(yī)療器械軟件自前次注冊(延續(xù)注冊除外)以來網(wǎng)絡(luò)安全更新的全部內(nèi)容����。
(三)現(xiàn)成軟件網(wǎng)絡(luò)安全研究資料
1.現(xiàn)成軟件組件網(wǎng)絡(luò)安全研究資料
(1)部分使用方式
對于部分使用方式��,即醫(yī)療器械軟件同時使用自研軟件和現(xiàn)成軟件組件��,無需單獨提交網(wǎng)絡(luò)安全研究報告�����,基于醫(yī)療器械軟件的安全性級別����,在自研軟件網(wǎng)絡(luò)安全研究報告適用條款中說明現(xiàn)成軟件組件的情況���。
適用條款包括軟件信息、數(shù)據(jù)架構(gòu)��、網(wǎng)絡(luò)安全能力����、網(wǎng)絡(luò)安全補丁、風(fēng)險管理��、需求規(guī)范��、驗證與確認���、可追溯性分析�、維護計劃��、漏洞評估�����、結(jié)論。
此時若現(xiàn)成軟件組件發(fā)生網(wǎng)絡(luò)安全更新�����,網(wǎng)絡(luò)安全功能更新在自研軟件網(wǎng)絡(luò)安全功能更新研究報告的基礎(chǔ)上��,說明現(xiàn)成軟件組件的變化情況���,不適用條款說明理由��;網(wǎng)絡(luò)安全補丁更新要求與自研軟件相同��。
(2)全部使用方式
對于全部使用方式��,即醫(yī)療器械軟件全部為現(xiàn)成軟件組件�,需要單獨提交現(xiàn)成軟件組件網(wǎng)絡(luò)安全研究報告����,其內(nèi)容與自研軟件研究報告相同���,但需基于現(xiàn)成軟件組件(此時即醫(yī)療器械軟件)的安全性級別予以說明�����。
此時若現(xiàn)成軟件組件發(fā)生網(wǎng)絡(luò)安全更新����,網(wǎng)絡(luò)安全功能更新在現(xiàn)成軟件組件網(wǎng)絡(luò)安全功能更新研究報告的基礎(chǔ)上,說明現(xiàn)成軟件組件的變化情況�,不適用條款說明理由;網(wǎng)絡(luò)安全補丁更新要求與自研軟件相同�。
2.外部軟件環(huán)境網(wǎng)絡(luò)安全評估資料
外部軟件環(huán)境網(wǎng)絡(luò)安全評估作為外部軟件環(huán)境評估的重要組成部分,其網(wǎng)絡(luò)安全及其更新的研究資料要求與外部軟件環(huán)境評估報告相同��,具體要求詳見醫(yī)療器械軟件指導(dǎo)原則第八章����。
考慮到醫(yī)療器械軟件指導(dǎo)原則已明確外部軟件環(huán)境評估報告要求,同時自研軟件網(wǎng)絡(luò)安全研究資料亦含有外部軟件環(huán)境的網(wǎng)絡(luò)安全補丁��、漏洞評估等要求����,故無需單獨提交外部軟件環(huán)境網(wǎng)絡(luò)安全評估資料。
七����、注冊申報資料補充說明[9]
注冊申報資料在符合醫(yī)療器械注冊申報資料要求等文件要求基礎(chǔ)上,滿足醫(yī)療器械軟件等相關(guān)指導(dǎo)原則要求���,同時重點關(guān)注以下要求��。
(一)產(chǎn)品注冊
1.軟件研究資料
在軟件研究資料中單獨提交自研軟件網(wǎng)絡(luò)安全研究報告�����。
若使用現(xiàn)成軟件組件�,根據(jù)其使用方式提交相應(yīng)研究資料。相關(guān)研究資料的具體要求詳見第六章����。
2.說明書
說明書提供網(wǎng)絡(luò)安全說明和使用指導(dǎo),明確用戶訪問控制機制��、電子接口(含網(wǎng)絡(luò)接口�、電子數(shù)據(jù)交換接口)及其數(shù)據(jù)類型和技術(shù)特征、網(wǎng)絡(luò)安全特征配置����、數(shù)據(jù)備份與災(zāi)難恢復(fù)、運行環(huán)境(含硬件配置�����、外部軟件環(huán)境����、網(wǎng)絡(luò)環(huán)境,若適用)��、安全軟件兼容性列表(若適用)�、外部軟件環(huán)境與安全軟件更新(若適用)、現(xiàn)成軟件清單(SBOM���,若適用)等要求����。
(二)變更注冊
1.軟件研究資料
醫(yī)療器械變更注冊應(yīng)根據(jù)網(wǎng)絡(luò)安全更新情況�,提交變化部分對產(chǎn)品安全性與有效性影響的研究資料:
(1)涉及網(wǎng)絡(luò)安全功能更新:適用于自研軟件發(fā)生網(wǎng)絡(luò)安全功能更新,或合并網(wǎng)絡(luò)安全補丁更新的情形��,此時單獨提交一份自研軟件網(wǎng)絡(luò)安全功能更新研究報告(或自研軟件網(wǎng)絡(luò)安全研究報告)�;
(2)僅發(fā)生網(wǎng)絡(luò)安全補丁更新:適用于自研軟件(含必備軟件、外部軟件環(huán)境)僅發(fā)生網(wǎng)絡(luò)安全補丁更新的情形����,此時單獨提交一份自研軟件網(wǎng)絡(luò)安全補丁更新研究報告;
(3)未發(fā)生網(wǎng)絡(luò)安全更新:出具真實性聲明����,明確對此承擔(dān)法律責(zé)任�。
若使用現(xiàn)成軟件組件����,根據(jù)其使用方式提交相應(yīng)研究資料。相關(guān)研究資料的具體要求詳見第六章�。
2.說明書
若適用,提交說明書關(guān)于網(wǎng)絡(luò)安全內(nèi)容的變更對比表����。
(三)延續(xù)注冊
延續(xù)注冊通常無需提交網(wǎng)絡(luò)安全相關(guān)研究資料。若適用����,根據(jù)注冊證“備注”所載明的要求提交相應(yīng)網(wǎng)絡(luò)安全研究資料。
產(chǎn)品技術(shù)要求“產(chǎn)品型號/規(guī)格及其劃分說明”所述軟件版本命名規(guī)則應(yīng)涵蓋網(wǎng)絡(luò)安全更新情況���,區(qū)分重大網(wǎng)絡(luò)安全更新和輕微網(wǎng)絡(luò)安全更新����。若原注冊產(chǎn)品標準(或原產(chǎn)品技術(shù)要求)及其變更對比表未體現(xiàn)軟件相關(guān)信息�����,需在符合性聲明中予以明確���,其中軟件版本命名規(guī)則需涵蓋網(wǎng)絡(luò)安全更新情況���。
八、參考文獻
[1] 全國人大. 中華人民共和國網(wǎng)絡(luò)安全法[Z]���,2016.11
[2] 全國人大. 中華人民共和國數(shù)據(jù)安全法[Z]����,2021.6
[3] 全國人大. 中華人民共和國個人信息保護法[Z]�,2021.8
[4] 國務(wù)院. 中華人民共和國人類遺傳資源管理條例(國令第717號)[Z],2019.5
[5] 中央網(wǎng)信辦. 國家網(wǎng)絡(luò)安全事件應(yīng)急預(yù)案[Z]���,2017.1
[6] 國家網(wǎng)信辦. 個人信息出境安全評估辦法(征求意見稿)[Z]�����,2019.6
[7] 國家網(wǎng)信辦. 數(shù)據(jù)出境安全評估辦法(征求意見稿)[Z]��,2021.10
[8] 國家網(wǎng)信辦. 網(wǎng)絡(luò)安全審查辦法[Z]�,2021.11
[9] 原國家食品藥品監(jiān)督管理總局.醫(yī)療器械說明書和標簽管理規(guī)定(總局令第6號)[Z]��,2014.7
[10] 原國家食品藥品監(jiān)督管理總局.醫(yī)療器械召回管理辦法(總局令第29號)[Z]�,2017.1
[11] 國家市場監(jiān)督管理總局. 醫(yī)療器械不良事件監(jiān)測和再評價管理辦法(總局令第1號)[Z]����,2018.8
[12] 國家市場監(jiān)督管理總局.醫(yī)療器械注冊與備案管理辦法(總局令第47號)[Z]����,2021.8
[13] 原國家食品藥品監(jiān)督管理總局.醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范(2014年第64號公告)[Z],2014.12
[14] 國家市場監(jiān)督管理總局.醫(yī)療器械注冊申報資料要求和批準證明文件格式(2021年第121號公告)[Z]�,2021.9
[15] 原國家食品藥品監(jiān)督管理總局.醫(yī)療器械網(wǎng)絡(luò)安全注冊技術(shù)審查指導(dǎo)原則(2017年第13號通告)[Z],2017.1
[16] 國家藥品監(jiān)督管理局.醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范附錄獨立軟件(2019年第43號通告)[Z]���,2019.7
[17] 國家藥品監(jiān)督管理局.醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范獨立軟件現(xiàn)場檢查指導(dǎo)原則(藥監(jiān)綜械管〔2020〕57號)[Z]�,2020.5
[18] 國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評中心. 醫(yī)療器械軟件技術(shù)審查指導(dǎo)原則(第二版)(征求意見稿)[Z]����,2020.5
[19] 北京市藥品監(jiān)督管理局. 醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則實施指南[Z],2019.12
[20]國家衛(wèi)生健康委員會. 國家健康醫(yī)療大數(shù)據(jù)標準����、安全和服務(wù)管理辦法(試行)(國衛(wèi)規(guī)劃發(fā)〔2018〕23號)[Z],2018.7
[21] GB9706.1-2020 醫(yī)用電氣設(shè)備 第1部分:基本安全和基本性能的通用要求[S]
[22] GB/T 20985.1-2017 信息技術(shù) 安全技術(shù) 信息安全事件管理 第1部分:事件管理原理[S]
[23] GB/T 22080-2016信息技術(shù)安全技術(shù)信息安全管理體系要求[S]
[24] GB/T 22081-2016信息技術(shù)安全技術(shù)信息安全管理實用規(guī)則[S]
[25] GB/T 22239-2019 信息安全技術(shù) 網(wǎng)絡(luò)安全等級保護基本要求[S]
[26] GB/T 25000.51-2016系統(tǒng)與軟件工程 系統(tǒng)與軟件質(zhì)量要求和評價(SQuaRE) 第51部分:就緒可用軟件產(chǎn)品(RUSP)的質(zhì)量要求和測試細則[S]
[27] GB/T 25070-2019 信息安全技術(shù) 網(wǎng)絡(luò)安全等級保護安全設(shè)計技術(shù)要求[S]
[28] GB/T 28448-2019 信息安全技術(shù) 網(wǎng)絡(luò)安全等級保護測評要求[S]
[29] GB/T 29246-2017 信息技術(shù)安全技術(shù)信息安全管理體系概述和詞匯[S]
[30] GB/T 30276-2020信息安全技術(shù) 網(wǎng)絡(luò)安全漏洞管理規(guī)范[S]
[31] GB/T 31167-2014信息安全技術(shù) 云計算服務(wù)安全指南[S]
[32] GB/T 31168-2014信息安全技術(shù) 云計算服務(wù)安全能力要求[S]
[33] GB/T 31722-2015 信息技術(shù) 安全技術(shù) 信息安全風(fēng)險管理[S]
[34] GB/T 35273-2020信息安全技術(shù) 個人信息安全規(guī)范[S]
[35] GB/T 35274-2017信息安全技術(shù) 大數(shù)據(jù)服務(wù)安全能力要求[S]
[36] GB/T 35278-2017信息安全技術(shù) 移動終端安全保護技術(shù)要求[S]
[37] GB/T 37964-2019信息安全技術(shù) 個人信息去標識化指南[S]
[38] GB/T 37973-2019信息安全技術(shù) 大數(shù)據(jù)安全管理指南[S]
[39] GB/T 37988-2019信息安全技術(shù) 數(shù)據(jù)安全能力成熟度模型[S]
[40] GB/T 39335-2020信息安全技術(shù) 個人信息安全影響評估指南[S]
[41] GB/T 39725-2020信息安全技術(shù) 健康醫(yī)療數(shù)據(jù)安全指南[S]
[42] GB/T信息安全技術(shù) 數(shù)據(jù)出境安全評估指南(征求意見稿)[S]��,2017.8
[43] GB/T信息安全技術(shù) 重要數(shù)據(jù)識別指南(征求意見稿)[S]�,2022.1
[44] YY/T 0287-2017 醫(yī)療器械 質(zhì)量管理體系 用于法規(guī)的要求[S]
[45] YY/T 0316-2016醫(yī)療器械 風(fēng)險管理對醫(yī)療器械的應(yīng)用[S]
[46] YY/T 0664-2020 醫(yī)療器械軟件 軟件生存周期過程[S]
[47] YY/T 1406.1-2016醫(yī)療器械軟件 第1部分:YY/T 0316應(yīng)用于醫(yī)療器械軟件的指南[S]
[48] YY/T 1708.1-2020醫(yī)用診斷X射線影像設(shè)備連通性符合性基本要求 第1部分:通用要求[S]
[49] YY/T 1708.2-2020醫(yī)用診斷X射線影像設(shè)備連通性符合性基本要求 第2部分:X射線計算機體層攝影設(shè)備[S]
[50] YY/T 1708.3-2021 醫(yī)用診斷X射線影像設(shè)備連通性符合性基本要求 第3部分:數(shù)字化攝影X射線機(DR)[S]
[51] YY/T 1708.4-2021 醫(yī)用X射線影像設(shè)備連通性符合性基本要求 第4 部分:數(shù)字減影血管造影X射線機(DSA)[S]
[52] YY/T 1708.5-2021 醫(yī)用診斷X射線影像設(shè)備連通性符合性基本要求 第5 部分:乳腺X射線機[S]
[53] YY/T 1708.6-2021 醫(yī)用診斷X射線影像設(shè)備連通性符合性基本要求 第6 部分:口腔X射線機[S]
[54] YY/T 醫(yī)用電氣設(shè)備網(wǎng)絡(luò)安全基本要求(報批稿)[S],2020.12
[55] IMDRF/SaMD WG/N12 FINAL: 2014, SaMD:Possible Framework for Risk Categorization and Corresponding Considerations[Z], 2014.9
[56] IMDRF/SaMD WG/N23 FINAL:2015,SaMD:Application of Quality Management System[Z], 2015.10
[57] IMDRF/CYBER WG/N60FINAL:2020, Principles and Practices for Medical Device Cybersecurity[Z], 2020.4
[58] FDA, Cybersecurity for Networked Medical Devices Containing Off-the-Shelf Software[Z], 2005.1
[59] FDA, Content of Premarket Submissions for Management of Cybersecurity in Medical Devices[Z], 2014.10
[60] FDA, Postmarket Management of Cybersecurity in Medical Devices[Z], 2016.12
[61] FDA, Design Considerations and Pre-market Submission Recommendations for Interoperable Medical Devices[Z], 2017.9
[62] FDA, Content of Premarket Submissions for Management of Cybersecurity in Medical Devices(Draft Guidance)[Z], 2018.10
[63] FDA, Best Practices for Communicating Cybersecurity Vulnerabilities to Patients[Z], 2021.10
[64] FDA, Playbook for Threat Modeling Medical Devices[Z], 2021.11
[65] MDCG 2019-16 Rev.1, Guidance on Cybersecurity for medical devices[Z], 2020.7
[66] BSI. Cybersecurity of medical devices:Addressing patient safety and the security of patient health information[Z], 2017.3
[67] AAMI TIR57:2016/(R)2019, Principles for medical device security - Risk management[S]
[68] AAMI TIR97:2019, Principles for medical device security - Postmarket risk management for device manufacturers[S]
[69] IEC TR 60601-4-5:2021, Medical electrical equipment - Part 4-5:Guidance and interpretation - Safety-related technical security specifications[S]
[70] IEC80001-1:2021, Application of risk management for IT-networks incorporating medical devices - Part 1:Safety, effectiveness and security in the implementation and use of connected medical devices or connected health software[S]
[71] IECTR 80001-2-1:2012, Application of risk management for IT-networks incorporating medical devices - Part 2-1: Step-by-step risk management of medical IT-networks - Practical applications and examples[S]
[72] IECTR 80001-2-2:2012, Application of risk management for IT-networks incorporating medical devices - Part 2-2: Guidance for the disclosure and communication of medical device security needs, risks and controls[S]
[73] IECTR 80001-2-3:2012, Application of risk management for IT-networks incorporating medical devices - Part 2-3: Guidance for wireless networks[S]
[74] IECTR 80001-2-4:2012, Application of risk management for IT-networks incorporating medical devices - Part 2-4: Application guidance - General implementation guidance for healthcare delivery organizations[S]
[75] IECTR 80001-2-5:2014, Application of risk management for IT-networks incorporating medical devices - Part 2-5: Application guidance - Guidance on distributed alarm systems[S]
[76] ISOTR 80001-2-6:2014, Application of risk management for IT-networks incorporating medical devices -Part 2-6: Application guidance - Guidance for responsibility agreements[S]
[77] ISOTR 80001-2-7:2015, Application of risk management for IT-networks incorporating medical devices -Application guidance -Part 2-7: Guidance for Healthcare Delivery Organizations (HDOs) on how to self-assess their conformance with IEC 80001-1[S]
[78] IECTR 80001-2-8:2016, Application of risk management for IT-networks incorporating medical devices - Part 2-8: Application guidance - Guidance on standards for establishing the security capabilities identified in IEC/TR 80001-2-2[S]
[79] IECTR 80001-2-9:2017, Application of risk management for IT-networks incorporating medical devices - Part 2-9: Application guidance - Guidance for use of security assurance cases to demonstrate confidence in IEC/TR 80001-2-2 security capabilities[S]
[80] IEC 80001-5-1:2021,Health software and health IT systems safety, effectiveness and security - Part 5-1: Security - Activities in the product life cycle[S]
[81] ISO 81001-1:2021, Health software and health IT systems safety, effectiveness and security - Part 1: Principles and concepts[S]
[82] ISO TS 81001-2-1, Health software and health IT systems safety,effectiveness and security - Part 2-1:Coordination - Guidance for the use of assurance cases for safety and security[S]
[83] ISO/IEC 27035-1:2016, Information technology - Security techniques - Information security incident management - Part 1: Principles of incident management[S]
[84] ISO/IEC 27035-2:2016, Information technology - Security techniques - Information security incident management - Part 2: Guidelines to plan and prepare for incident response[S]
[85] ISO/IEC 29147:2018, Information Technology - Security Techniques - Vulnerability Disclosure[S]
[86] ISO/IEC 30111:2013, Information Technology - Security Techniques - Vulnerability Handling Processes[S]
[87] ISO 27799:2016, Health informatics - Information security management in health using ISO/IEC 27002[S]
[88] NEMA CSP 1-2016, Cybersecurity for Medical Imaging[S]
[89] NEMA HN 1-2019, Manufacturer Disclosure Statement for Medical Device Security[S]
[90] UL 2900-1:2020, Standard for Software Cybersecurity for Network Connectable Products - Part 1: General Requirements[S]
[91] UL 2900-2-1:2018, Software Cybersecurity for Network Connectable Products - Part 2-1: Particular Requirements for Network Connectable Components of Healthcare and Wellness Systems[S]