對(duì)于醫(yī)療器械注冊(cè)項(xiàng)目來說,企業(yè)特別關(guān)系兩個(gè)問題�,一是醫(yī)療器械注冊(cè)費(fèi)用,一是醫(yī)療器械注冊(cè)時(shí)長(zhǎng)�。本文從上海藥品監(jiān)督管理局、浙江省藥品監(jiān)督管理局公開發(fā)布的2023年10月份數(shù)據(jù)�,帶大家一起了解上海、浙江醫(yī)療器械注冊(cè)時(shí)長(zhǎng)�����。
對(duì)于醫(yī)療器械注冊(cè)項(xiàng)目來說����,企業(yè)特別關(guān)系兩個(gè)問題,一是醫(yī)療器械注冊(cè)費(fèi)用��,一是醫(yī)療器械注冊(cè)時(shí)長(zhǎng)�。本文從上海藥品監(jiān)督管理局、浙江省藥品監(jiān)督管理局公開發(fā)布的2023年10月份數(shù)據(jù)���,帶大家一起了解上海���、浙江醫(yī)療器械注冊(cè)時(shí)長(zhǎng)。

一���、上海第二類醫(yī)療器械注冊(cè)時(shí)長(zhǎng)
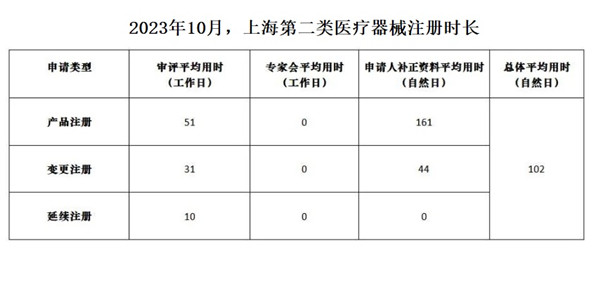
備注:
1��、審評(píng)平均用時(shí)均為工作日��;申請(qǐng)人補(bǔ)正資料平均用時(shí)和總體平均用時(shí)均為自然日�。
2�、申請(qǐng)人補(bǔ)正資料平均用時(shí)=補(bǔ)正資料總用時(shí)/相關(guān)項(xiàng)目審結(jié)轉(zhuǎn)出總數(shù)量;總體平均用時(shí)=產(chǎn)品注冊(cè)�、變更注冊(cè)、延續(xù)注冊(cè)的總用時(shí)/相關(guān)項(xiàng)目審結(jié)轉(zhuǎn)出總數(shù)量�����。
二、浙江第二類醫(yī)療器械注冊(cè)審評(píng)情況
1.第二類醫(yī)療器械注冊(cè)審評(píng)將情況:
2023年10月��,浙江省轉(zhuǎn)入醫(yī)療器械注冊(cè)審評(píng)程序115項(xiàng)��。轉(zhuǎn)出審結(jié)項(xiàng)目201項(xiàng)
2.專家評(píng)審會(huì)情況
10月共組織召開專家咨詢會(huì)議4次����。
3.創(chuàng)新醫(yī)療器械特別審查情況
2023年10月,收到創(chuàng)新醫(yī)療器械特別審查申請(qǐng)1項(xiàng)����。獲準(zhǔn)進(jìn)入創(chuàng)新特別審查程序0項(xiàng)。